Thụ thể yếu tố tăng trưởng biểu mô (Epidermal Growth Factor Receptor – EGFR) là thụ thể trên bề mặt tế bào tiếp nhận tín hiệu từ các yếu tố tăng trưởng để kích thích tế bào sinh trưởng, phân chia, biệt hóa,…
1. Cấu trúc và chức năng của EGFR
EGFR là thành viên của họ thụ thể ErbB (Erythroblastic B), bao gồm 4 thành viên: EGFR (ErbB-1), HER2/neu (ErbB-2), HER3 (ErbB-3) và HER4 (ErbB-4). Protein EGFR gồm 1210 axit amin, có cấu trúc gồm 3 vùng: vùng ngoại bào chứa miền tương tác với yếu tố tăng trưởng, vùng xuyên màng và vùng nội bào chứa miền kinase có thể phosphoryl hóa tyrosine của protein (nên được gọi là thụ thể tyrosine kinase). Khi yếu tố tăng trưởng biểu mô liên kết vào thụ thể, hai phân tử EGFR kết hợp với nhau (dimer hóa), từ đó tự phosphoryl hóa vùng tyrosine kinase, giúp EGFR kết hợp được với các phân tử tín hiệu ở giai đoạn sau của con đường tín hiệu (Hình 1). Tín hiệu từ EGFR có thể được truyền qua con đường Ras/Raf/MEK/ERK hoặc PI3K/AKT/mTOR vào nhân để điều khiển tế bào tăng trưởng, biệt hóa, phân chia, tăng sinh mạch máu, tránh sự tự chết theo chương trình (apoptosis),…

Hình 1. Mô hình cấu trúc và hoạt động của thụ thể yếu tố tăng trưởng biểu mô
(A) Thụ thể yếu tố tăng trưởng biểu mô (EGFR) gồm ba vùng: vùng ngoại bào chứa miền tương tác với yếu tố tăng trưởng, vùng xuyên màng tế bào, và vùng nội bào chứa miền tyrosine kinase. (B) Hoạt động của EGFR: khi yếu tố tăng trưởng biểu mô liên kết vào thụ thể, hai phân tử EGFR kết hợp với nhau (dimer hóa), từ đó tự phosphoryl hóa vùng tyrosine kinase giúp EGFR kết hợp được với các phân tử tín hiệu ở giai đoạn sau của con đường tín hiệu.
2. Các dạng biến đổi của EGFR trong ung thư
Trong nhiều bệnh ung thư, các con đường tín hiệu phụ thuộc EGFR thường được kích hoạt liên tục dẫn đến tế bào phân chia mất kiểm soát. Hai cơ chế chính dẫn đến hiện tượng này bao gồm biểu hiện quá mức (overexpression) protein hoặc đột biến gen EGFR.
Biểu hiện quá mức protein EGFR
Sự biểu hiện quá mức EGFR được phát hiện trong nhiều bệnh ung thư như ung thư phổi không tế bào nhỏ (40-80% số trường hợp), u nguyên bào thần kinh đệm (50%), ung thư biểu mô vùng đầu cổ (80-100%). Nguyên nhân của hiện tượng này do khuếch đại gen EGFR hoặc protein được tổng hợp liên tục, từ đó số lượng thụ thể trên bề mặt tế bào tăng gấp nhiều lần so với bình thường, liên tục kích hoạt các con đường tín hiệu phụ thuộc EGFR giúp tế bào phân chia mất kiểm soát, dẫn đến ung thư. Trong ung thư phổi không tế bào nhỏ, sự khuếch đại gen EGFR được coi là một dấu hiệu tiên lượng tốt, khi một số nghiên cứu chỉ ra rằng hiện tượng này có liên quan đến tỷ lệ sống còn tốt hơn đáng kể sau khi điều trị bằng các thuốc ức chế tyrosine kinase (tyrosine kinase inhibitor – TKI) của EGFR (tuy nhiên sự biểu hiện quá mức EGFR không được chấp nhận để lựa chọn bệnh nhân điều trị TKI).
Đột biến gen EGFR
Gen EGFR ở người nằm ở vị trí 7p12, gồm 30 exon, là một trong những gen dễ bị đột biến nhất trong các loại ung thư.
Vị trí đột biến thường xảy ra nhất là exon 18-21 (đoạn mã hóa miền tyrosine kinase của protein). Phân tử EGFR sinh ra trong trường hợp này có miền tyrosine kinase bị biến đổi, có khả năng tự phosphoryl hóa để phát ra tín hiệu nội bào, do đó các con đường tín hiệu phụ thuộc EGFR (chủ yếu là con đường Ras/Raf/MEK/ERK) được kích hoạt liên tục mà không cần sự có mặt của yếu tố tăng trưởng, làm tế bào phân chia mất kiểm soát gây nên ung thư. Đột biến trên exon 18-21 gen EGFR gặp ở nhiều loại ung thư như ung thư phổi không tế bào nhỏ (10-40%), đại trực tràng, vú, dạ dày,…
Trong ung thư biểu mô tế bào vảy của phổi, u nguyên bào thần kinh đệm, ung thư vú, buồng trứng, tuyến tiền liệt,… còn phát hiện các trường hợp đột biến gen EGFR ở exon 2-7, tiêu biểu nhất là mất toàn bộ đoạn exon 2-7 (đột biến EGFRvIII). Dạng đột biến này làm vùng ngoại bào của thụ thể không liên kết được với yếu tố tăng trưởng, tuy nhiên vùng tyrosine kinase vẫn được kích hoạt (cơ chế của hiện tượng này còn chưa được hiểu rõ), từ đó kích thích con đường PI3K/AKT/mTOR, làm tế bào hoạt động bất thường dẫn đến ung thư. Hiện nay ý nghĩa và tỷ lệ dạng đột biến này vẫn chưa được xác định rõ ràng.
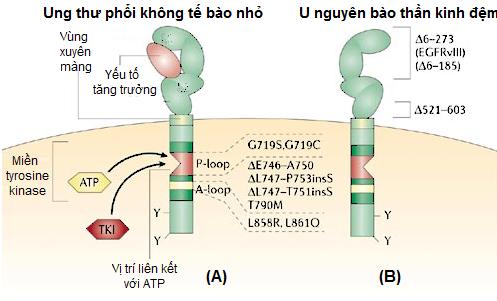
Hình 2. Các dạng đột biến gen EGFR
(A) Đột biến trên exon 18-21 khiến miền tyrosine kinase có khả năng tự hoạt hóa và phát ra tín hiệu nội bào; (B) Đột biến trên exon 2-7 làm vùng ngoại bào mất khả năng liên kết với yếu tố tăng trưởng.
3. Điều trị ung thư bằng các thuốc hướng đích EGFR
Các thuốc điều trị đích EGFR
Các thuốc điều trị đích EGFR gồm 2 nhóm: kháng thể đơn dòng kháng EGFR và phân tử nhỏ ức chế vùng tyrosine kinase (tyrosine kinase inhibitor – TKI) của EGFR.
Các kháng thể đơn dòng kháng EGFR có khả năng liên kết chặt chẽ với thụ thể, khiến yếu tố tăng trưởng không tiếp cận được với thụ thể (Hình 3A). Những thuốc này được chỉ định trong trường hợp có sự biểu hiện quá mức EGFR trên bề mặt tế bào. Một số thuốc thuộc nhóm này như Cetuximab (điều trị ung thư đại trực tràng, ung thư vùng đầu – cổ), Panitumumab (ung thư đại trực tràng), Nimotuzumab (ung thư vùng đầu – cổ, u nguyên bào thần kinh đệm, ung thư tụy).

Hình 3. Cơ chế kháng EGFR của kháng thể đơn dòng
(A) Các kháng thể đơn dòng liên kết chặt chẽ với EGFR, khiến yếu tố tăng trưởng không liên kết được với thụ thể, từ đó ức chế các con đường tín hiệu phụ thuộc EGFR; (B) Tuy nhiên trong trường hợp KRAS bị đột biến, nó có khả năng tự phát ra tín hiệu nội bào để kích hoạt trở lại các con đường tín hiệu mà không phụ thuộc tín hiệu từ EGFR.
Các thuốc TKI cạnh tranh với ATP về vị trí liên kết trên phân tử EGFR (Hình 2A), do đó vùng tyrosine kinase không có nguyên liệu phosphate để thực hiện quá trình tự phosphoryl hóa và phát tín hiệu nội bào. Hiệu quả điều trị bằng các thuốc TKI có liên quan đến tình trạng đột biến trên exon 18-21 gen EGFR: Gefitinib (điều trị ung thư phổi không tế bào nhỏ), Erlotinib (ung thư phổi không tế bào nhỏ, ung thư tụy) cần có đột biến gen trên exon 18, 19 và 21, Afatinib (ung thư phổi không tế bào nhỏ) có hiệu quả cao hơn trên bệnh nhân có đột biến gen, Osimertinib (ung thư phổi không tế bào nhỏ) là thuốc hướng đích EGFR T790M.
Kháng thuốc điều trị đích EGFR
Sau một thời gian sử dụng các thuốc điều trị đích EGFR, đa số các bệnh nhân sẽ xuất hiện tình trạng kháng thuốc. Hiện tượng này có thể xảy ra do sự thay đổi cấu trúc phân tử EGFR khiến thuốc không gắn được vào thụ thể, ví dụ đột biến T790M trên exon 20 khiến vùng tyrosine kinase thay đổi cấu trúc vị trí liên kết với ATP, làm các TKI thế hệ đầu (Gefitinib, Erlotinib) không tương tác được với vị trí này. Nguyên nhân thứ hai có thể do đột biến ở một trong các protein phía sau EGFR trong chuỗi truyền tín hiệu (RAS, RAF, PI3K,…), làm các phân tử này có thể tự hình thành tín hiệu nội bào mà không phụ thuộc tín hiệu từ EGFR (Hình 3B). Cơ chế thứ ba, khi tín hiệu nội bào từ EGFR bị ức chế, tế bào có thể chuyển sang kích hoạt mạnh mẽ hơn các con đường tín hiệu khác, như các con đường phụ thuộc thụ thể HER2/neu, thụ thể MET, thụ thể RET (thông tin chi tiết hơn có thể tham khảo từ bài viết: “Cập nhật một số vấn đề về xét nghiệm sinh học phân tử và điều trị đích trong ung thư phổi không tế bào nhỏ”; http://ungthubachmai.com.vn/kin-thc-y-khoa/item/3082- cập-nhật-một-số-vấn-đề-về-xét-nghiệm-sinh-học-phân-tử-và-điều-trị-đích-trong-ung-thư-phổi-không-tế-bào-nhỏ.html).
TÀI LIỆU THAM KHẢO
1. Mai Trọng Khoa (2016). Kháng thể đơn dòng và phân tử nhỏ trong điều trị bệnh ung thư. Nhà xuất bản Y học, Hà Nội.
2. Helleday T, Eshtad S and Nik–Zainal S (2014). Mechanisms underlying mutational signatures in human cancers. Nature Reviews Genetics.
3. Tannock I, Hill R, Bristow R, Harrington L (2013). The Basic Science of Oncology, 5th Edition. McGraw–Hill Education LLC.
4. Kumar V, Abbas A, Aster J (2013). Robbins basic pathology. Philadelphia: Elsevier/Saunders.
5. Cheng L, Alexander RE, et al. (2012). Molecular pathology of lung cancer: key to personalized medicine. Modern Pathology 25: 347–369.