TỔNG QUAN VỀ
HIỆU QUẢ CỦA ĐIỀU TRỊ ĐA MÔ THỨC CHO
UNG THƯ BIỂU MÔ TẾ BÀO GAN QUÁ CHỈ ĐỊNH PHẪU THUẬT: ĐÁNH GIÁ QUA CA LÂM SÀNG ĐƠN LẺ
ThS. Nguyễn Duy Anh, GS. TS. Mai Trọng Khoa, PGS. TS. Phạm Cẩm Phương,
Trung tâm Y Học Hạt Nhân & Ung Bướu, bệnh viện Bạch Mai
1. Tổng quan
Ung thư biểu mô tế bào gan (UTBMTBG) – Hepatocellular carcinoma là bệnh ung thư phát triển từ tế bào gan nằm trong nhóm bệnh ung thư gan (UTG) nguyên phát cùng với ung thư đường mật trong gan, sarcoma… Theo thống kê của GLOBOCAN 2020 trên toàn thế giới trong các bệnh ung thư thường gặp nhất, thì UTG đứng hàng thứ 7 về tỉ lệ mắc mới và thứ 3 về tỉ lệ gây tử vong [1]. Tại Việt Nam UTG đứng hàng đầu cả về tỉ lệ bệnh nhân mắc mới và tỉ lệ tử vong, không những vậy bệnh còn có xu hướng ngày càng tăng [2]. Trong nhóm bệnh UTG chiếm tới 85% số ca bệnh là UTBMTBG, nguyên nhân gây bệnh hàng đầu viêm gan virus B-C, xơ gan do rượu… Việt Nam, một trong những nước có tỉ lệ mắc bệnh UTBMTBG cao nhất toàn cầu khảo sát dịch tễ thấy rằng nguyên nhân gây bệnh hay gặp nhất là viêm gan virus B [3]. Khu vực Châu Phi nguyên nhân gây bệnh thường gặp nhất là do viêm gan virus C, các nước khu vực Châu Âu hay Mỹ thì nguyên nhân thường gặp là do xơ gan rượu hoặc viêm gan nhiễm mỡ mạn tính không do rượu.
Ở nước ta, UTBMTBG khi mới phát hiện phần lớn ở giai đoạn muộn khiến gánh nặng bệnh tật cao, tiên lượng của người bệnh xấu (thời gian sống còn toàn bộ hay thời gian bệnh không tiến triển khi điều trị đều ngắn) [4,5]. Có nhiều phương pháp điều trị UTBMTBG tuy nhiên bệnh ở giai đoạn muộn thì tỉ lệ sống sót thấp – giảm dần qua từng năm. Việc điều trị hiện nay có nhiều tiến bộ, liên tục cập nhật cải thiện được tiên lượng bệnh. Trong đó việc có kế hoạch điều trị kết hợp nhiều phương pháp (đồng thời hoặc tiếp nối) đã đem lại kết quả tích cực cho nhiều người bệnh [6,7].
Dưới đây là tóm tắt một số ca lâm sàng để minh họa về hiệu quả của điều trị đa mô thức cho các bệnh nhân ung thư biểu mô tế bào gan đã quá chỉ định phẫu thuật:
2. Báo cáo ca lâm sàng
2.1. Ca lâm sàng 1
• Bệnh nhân nam 70 tuổi, lý do vào viện vì đau tức bụng hạ sườn phải.
Tiền sử khỏe mạnh.
• Triệu chứng lâm sàng lúc vào viện:
- Tỉnh, tiếp xúc tốt
- Da, niêm mạc hồng
- Bụng mềm, không chướng, gan-lách không sờ thấy
- Tuần hoàn bang hệ (-)
- Các cơ quan bộ phận khác không phát hiện bất thường
• Xét nghiệm cận lâm sàng:
- Siêu âm ổ bụng: Nhu mô gan trái và phải có khối tăng âm
- CT scanner ngực-bụng: U gan đa ổ 2 bên phải và trái tính chất động học của HCC kích thước lớn nhất 7,9x10,4cm. Không có huyết khối tĩnh mạch cửa. Lồng ngực hiện không phát hiện tổn thương nghi thứ phát.
- AFP: 99,5ng/mL AFP-L3: 14,3% Pivka-II: 8194mAU/mL
- Creatinine: 87µmol/L Albumin: 36,4g/L Bilirubin total: 10,0µmol/L
- GOT/GPT: 74/86U/mL HBsAg: (+) Anti-HCV: (-)
- Định lượng HBV-DNA: 3,4x106cp/mL PT%: 74,4%
- Hồng cầu: 4,63T/L Bạch cầu: 6,9G/L Tiểu cầu: 216G/L
- Nội soi dạ dày – thực quản và đại trực tràng: Viêm dạ dày – Trĩ nội độ I
• Chẩn đoán xác định: UTBMTBG giai đoạn BCLC B – Xơ gan child A - VGB
• Phương pháp điều trị: Nút mạch hóa chất (Transcatheter Arterial Chemoembolization – TACE) + thuốc kháng virus Tenofovir 300mg/ngày
• Đánh giá đáp ứng:
| Trước điều trị | Sau TACE lần 1 | Sau TACE lần 2 |
| 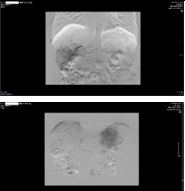
Hình 1. Quá trình nút mạch khối u gan hai bên lần 1 | 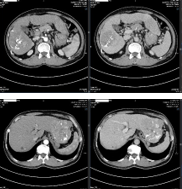
Hình 2. Kết quả chụp CT bụng sau 1 tháng, khối u gan hai bên vẫn tăng sinh mạch nhiều | 
Hình 3. Quá trình nút mạch khối u gan hai bên lần 2 |
| AFP: 99,5ng/mL AFP-L3: 14,3% Pivka-II: 8194mAU/mL | AFP: 347,8ng/mL AFP-L3: 35,0% Pivka-II: 6475mAU/mL | AFP: 1064,8ng/mL AFP-L3: 36% Pivka-II: 5089mAU/mL |
Bảng 1. Đánh giá đáp ứng điều trị sau 2 lần TACE chất chỉ điểm u tăng dần
• Điều trị tiếp theo: TACE lần 3
| TACE lần 3 | Sau 1 tháng |
| 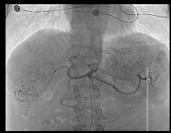
Hình 4. Quá trình nút mạch khối u gan hai bên lần 3 | 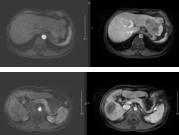
Hình 5. Kết quả chụp MRI gan-mật sau TACE lần 3 một tháng, khối u gan hai bên vẫn tăng sinh mạch nhiều, có nốt mới cạnh khối cũ, huyết khối nhánh phải tĩnh mạch cửa |
| | AFP: 1432ng/mL AFP-L3: 43% Pivka-II: 6023mAU/mL |
Bảng 2. Đánh giá đáp ứng điều trị sau TACE lần 3 chất chỉ điểm u tiếp tục tăng
=> Bệnh nhân được chuyển sang điều trị thuốc đích Sorafenib 800mg/ngày
• Đánh giá đáp ứng:
Sau 1 tháng Sau 3 tháng Sau 6 tháng Sau 8 tháng
| Sau 1 tháng | Sau 3 tháng | Sau 6 tháng | Sau 8 tháng |
| 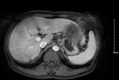
Hình 6. Huyết khối nhánh phải tĩnh mạch cửa | | | 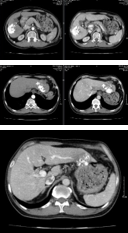
Hình 7. Khối u gan phải và trái giảm kích thước (max 5,0x4,2cm) chỉ còn một phần nhỏ ngấm thuốc – Tái thông nhánh phải tĩnh mạch cửa |
| AFP: 956,0ng/mL | AFP: 113,1ng/mL AFP-L3: 22,4% Pivka-II: 689mAU/mL | AFP: 17,1ng/mL | AFP: 109,0ng/mL |
Bảng 3. Đánh giá đáp ứng điều trị bằng Sorafenib
=> Sau điều trị với Sorafenib đạt đáp ứng một phần đến tháng thứ 9 bệnh nhân chuyển sang điều trị bước 2 thuốc đích khác.
2.2. Ca lâm sàng 2
• Bệnh nhân nam 47 tuổi, vào viện vì đau bụng hạ sườn phải.
Tiền sử khỏe mạnh.
• Triệu chứng lâm sàng lúc vào viện:
- Tỉnh, tiếp xúc tốt
- Da, niêm mạc hồng
- Bụng mềm, không chướng, gan-lách không sờ thấy
- Tuần hoàn bang hệ (-)
- Các cơ quan bộ phận khác không phát hiện bất thường
- Chiều cao 170cm, cân nặng 56kg
• Xét nghiệm cận lâm sàng:
- Siêu âm ổ bụng: Khối u gan phải theo dõi thể thâm nhiễm
- CT scanner ngực-bụng: U gan phải tính chất HCC thể thâm nhiễm, kích thước ~ 58x80x77mm xâm lấn tĩnh mạch cửa (Vp2) - hạ phân thùy II có nốt giảm tỷ trọng ngấm thuốc kém đường kính 8mm. Lồng ngực hiện không phát hiện tổn thương nghi thứ phát.
- AFP: 289,4ng/mL AFP-L3: 42% Pivka-II: 5382mAU/mL
- Creatinine: 92µmol/L Albumin: 44,8g/L Bilirubin total: 6,2µmol/L
- GOT/GPT: 37/28U/mL HBsAg: (+) Anti-HCV: (-)
- Định lượng HBV-DNA: 2,7x104cp/mL PT%: 96,4%
- Hồng cầu: 4,88T/L Bạch cầu: 9,08G/L Tiểu cầu: 142G/L
- Nội soi dạ dày – thực quản và đại trực tràng: Viêm dạ dày – Đại trực tràng không phát hiện bất thường.
• Chẩn đoán xác định: UTBMTBG giai đoạn BCLC C – Xơ gan child A - VGB
• Phương pháp điều trị: Dùng thuốc đích Lenvatinib 8mg/ngày + thuốc kháng virus Tenofovir 300mg/ngày
• Đánh giá đáp ứng:
| Trước điều trị | Sau 1 tháng | Sau 2 tháng |
| Hình 8. Khối u gan phải thể thâm nhiễm, xâm lấn tĩnh mạch cửa | | Hình 9. Khối u gan phải co nhỏ kích thước 54x67mm ranh giới rõ, còn tăng sinh mạch ít – Không còn nốt gan trái |
| AFP: 289,4ng/mL AFP-L3: 42% Pivka-II: 5382mAU/mL | AFP: 112,6ng/mL AFP-L3: 40% Pivka-II: 2756mAU/mL | AFP: 66,0ng/mL AFP-L3: 31,3% Pivka-II: 1109mAU/mL |
Bảng 4. Đánh giá đáp ứng điều trị bằng Lenvatinib
• Điều trị tiếp theo: Điều trị Lenvatinib kết hợp nút mạch. Sau 1 tháng đạt được đáp ứng hoàn theo tiêu chí mRECIST -> người bệnh được điều trị tiếp bằng phẫu thuật cắt gan.
| Lenvatinib + TACE | Trước phẫu thuật | Sau phẫu thuật |
| Hình 10. TACE u gan | Hình 11. Khối u gan phải co nhỏ ranh giới rõ, không tăng sinh mạch – Không còn nốt gan trái | Hình 12. Ổ tụ dịch vết mổ - Nhu mô gan còn lại không thấy khối nốt bất thường |
| AFP: 66,0ng/mL AFP-L3: 31,3% Pivka-II: 1109mAU/mL | AFP: 49ng/mL AFP-L3: 28% Pivka-II: 533mAU/mL | AFP: 7,37ng/mL |
Bảng 5. Đánh giá đáp ứng điều trị sau phẫu thuật
• Đánh giá đáp ứng: Bệnh đáp ứng hoàn toàn
3. Bàn luận
Nút mạch (TACE) u gan là phương pháp điều trị đầu tay với UTBMTBG giai đoạn trung gian bởi thực hiện không phức tạp, hiệu quả khống chế bệnh tốt, tỉ lệ tác dụng phụ khá thấp [8,9]. Tuy nhiên vẫn có một tỉ lệ không nhỏ bệnh nhân được nút mạch khối u gan không đáp ứng điều trị. Định nghĩa kháng TACE (hay TACE thất bại) được xem xét và xây dựng qua nhiều nghiên cứu, tuy nhiên cho đến năm 2010 lần đầu tiên một thang điểm đánh giá do các bác sĩ Nhật Bản công bố để xác định như nào là kháng trị với TACE được chấp nhận rộng rãi ở nhiều nước khác nhau [10]. Tiếp sau đó một thang điểm đánh giá khác do các bác sĩ Châu Âu công bố cũng được áp dụng cho đến hiện nay [11]. Nhưng tổng kết lại nếu sau nút mạch mà khối u vẫn còn ngấm thuốc (thuốc cản quang hoặc đối quang từ khi chụp đánh giá sau điều trị), xuất hiện tổn thương mới hoặc chỉ cần chất chỉ điểm u tăng thì kể cả mới nút mạch 1 lần cũng cần cân nhắc thay đổi kế hoạch điều trị. Xác định kháng TACE giúp người bệnh sớm chuyển phương pháp điều trị để đạt được hiệu quả tốt hơn, tránh suy gan do tác dụng phụ của việc nút mạch [12,13]. Quan điểm về điều trị bệnh nhân UTBMTBG giai đoạn trung gian quá chỉ định phẫu thuật đã có nhiều thay đổi, tùy thuộc vào kích thước, số lượng khối u mà lựa chọn TACE, liệu pháp toàn thân (thuốc đích hay liệu pháp miễn dịch) hoặc phối hợp 2 phương pháp [14,15]. Sorafenib và Lenvatinib là những thuốc đích được khuyến cáo điều trị ngay bước 1 cho bệnh nhân UTBMTBG giai đoạn trung gian không phẫu thuật được không phù hợp với TACE hoặc đã kháng TACE [6,10].
Việc điều trị tân bổ trợ để giảm giai đoạn bệnh trước điều trị triệt căn đem lại lợi ích lớn cho người bệnh, không những kéo dài thời gian sống còn toàn bộ và bệnh không tiến triển mà còn có thể điều trị khỏi bệnh. Đầu tiên, điều trị tân bổ trợ làm giảm giai đoạn bệnh UTBMTBG từ không thể phẫu thuật được thành phẫu thuật được (có thể cắt gan hoặc ghép gan). Bởi điều trị tân bộ trợ làm giảm kích thước, số lượng khối u và còn làm tăng thể tích gan lành [16]. Nhiều nghiên cứu còn chỉ ra rằng tỉ lệ sống còn toàn bộ sau 5 năm của bệnh nhân UTBMTBG không mổ được điều trị tân bổ trợ sau đó phẫu thuật có thể so sánh với bệnh nhân giai đoạn sớm mổ được (24,9-57,0% so với 42,0-64,0%) [17,18,19]. Ngoài ra, ở nhóm có thể phẫu thuật được những bệnh nhân được điều trị tân bổ trợ có tỉ lệ sống 5 năm không bệnh cao hơn bệnh nhân không điều trị (~50% so với ~31%) [20]. Thứ hai, cải thiện tiên lượng ở nhóm bệnh nhân ghép gan. Trước đây bệnh nhân nằm ngoài tiêu chuẩn ghép gan Milan có tiên lượng tồi hơn so với nằm trong tiêu chuẩn. Song các nghiên cứu gần đây cho thấy rằng sau điều trị tân bổ trợ thì có tới 25-70% bệnh nhân mắc UTBMTBG ngoài tiêu chí Milan đạt được giai đoạn thấp hơn của khối u sau khi được điều trị tân bổ trợ, sau đó họ được ghép gan và đạt được tiên lượng tương đương với những người có thể ghép gan ngay ban đầu [21]. Thứ ba, điều trị tân bổ trợ có thể ngăn chặn khối u tiến triển trong thời gian chờ đợi ghép gan. Có khoảng 20% bệnh nhân trong 6 tháng chờ ghép gan không điều trị bị khối u tiến triển và không ghép gan được nữa. Nhất là những bệnh nhân có chất chỉ điểm u tăng cao (nhất là khi AFP > 500ng/mL) [22,23]. Điều trị tân bổ trợ có thể giảm tỷ lệ nói trên xuống <10% [24].
Điều trị tân bổ trợ có thể TACE, xạ trị trong chọn lọc (Selective Internal Radiation Therapy – SIRT), liệu pháp toàn thân… có thể là đơn liệu pháp hoặc kết hợp [14].
4. Kết luận
Điều trị UTBMTBG cho đến nay đã có nhiều thay đổi tích cực, nhiều phương pháp điều trị phối hợp giúp kéo dài thời gian sống cho người bệnh. Quan trọng là cần kế hoạch điều trị phù hợp với từng thời điểm bệnh xuyên suốt quá trình điều trị.
Tài liệu tham khảo
1. Hyuna Sung PhD, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: A Cancer Journal for Clinicians. 2021; 71(3): 209-249. doi: 10.3322/caac.21660.
2. Linh Ha, et al. Proportion and number of cancer cases and deaths attributable to behavioral risk factors in Vietnam. International Journal of Cancer. 2023; 153(3): 524-538. doi: 10.1002/ijc.34549.
3. Josep M. Llovet, et al. Hepatocellular carcinoma. Nature Reviews Disease Primers. 2021; 7(6). doi: 10.1038/s41572-020-00240-3.
4. Nguyễn Công Long, et al. Một số đặc điểm dịch tễ và lâm sàng bệnh nhân ung thư biểu mô tế bào gan tại bệnh viện Bạch Mai giai đoạn 2018 – 2019. Tạp chí Y Học Dự Phòng. 2022; 32(2): 123-128. doi: 10.51403/0868-2836/2022/594.
5. Lê Hoài Thương, et al. Một số đặc điểm dịch tễ, lâm sàng và cận lâm sàng của bệnh nhân ung thư biểu mô tế bào gan tại bệnh viện Đại Học Y Hà Nội. Tạp chí Nghiên Cứu Y Học. 2021; 147(11): 92-100. Doi: 10.52852/tcncyh.v147i11.510.
6. National Comprehensive Cancer Network. Hepatocellular Carrcinoma, version 2.2023. NCCN Clinical Practice Guideline in Oncology. 2023. Available at: https://www.nccn.org/professionals/physician_gls/pdf/hcc.pdf.
7. Bộ Y Tế. Hướng dẫn chẩn đoán và điều trị ung thư biểu mô tế bào gan. 2020. Quyết định số 3129/QĐ-BYT.
8. Riccardo Lencioni, et al. Chemoembolization of Hepatocellular Carcinoma. Semin Intervent Radiol. 2013; 30(1): 3–11. doi: 10.1055/s-0033-1333648.
9. Evgenia Kotsifa, et al. Transarterial Chemoembolization for Hepatocellular Carcinoma: Why, When, How?. J Pers Med. 2022; 12(3): 436. doi: 10.3390/jpm12030436.
10. Masatoshi Kudo, et al. Transarterial chemoembolization failure/refractoriness: JSH-LCSGJ criteria 2014 update. Oncology. 2014; 87(1):22-31. doi: 10.1159/000368142.
11. Shen Zhang, et al. Transarterial chemoembolization failure/refractoriness: A scientific concept or pseudo-proposition. World J Gastrointest Surg. 2022; 14(6): 528–537. doi: 10.4240/wjgs.v14.i6.528.
12. Josep M Llovet, et al. Design and endpoints of clinical trials in hepatocellular carcinoma. J Natl Cancer Inst. 2008; 100(10):698-711. doi: 10.1093/jnci/djn134.
13. C Verslype, et al. Hepatocellular carcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2012; 7(7): 41-8. doi: 10.1093/annonc/mds225.
14. Maria Reig, et al. BCLC strategy for prognosis prediction and treatment recommendation: The 2022 update. J Hepatol. 2022; 76(3):681-693. doi: 10.1016/j.jhep.2021.11.018.
15. A Vogel, et al. Updated treatment recommendations for hepatocellular carcinoma (HCC) from the ESMO Clinical Practice Guidelines. Ann Oncol. 2021; 32(6):801-805. doi: 10.1016/j.annonc.2021.02.014.
16. Zhao-You Tang, et al. Downstaging followed by resection plays a role in improving prognosis of unresectable hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2004; 3(4):495-8.
17. Ismail Labgaa, et al. Comparison of Partial Hepatectomy and Transarterial Chemoembolization in Intermediate-Stage Hepatocellular Carcinoma: A Systematic Review and Meta-Analysis. Liver Cancer. 2020; 9(2):138-147. doi: 10.1159/000505093.
18. Wan Yee Lau, et al. Salvage surgery following downstaging of unresectable hepatocellular carcinoma--a strategy to increase resectability. Ann Surg Oncol. 2007; 14(12):3301-9. doi: 10.1245/s10434-007-9549-7.
19. Wan-yee Lau, et al. Salvage surgery following downstaging of unresectable hepatocellular carcinoma. Ann Surg. 2004; 240(2):299-305. doi: 10.1097/01.sla.0000133123.11932.19.
20. Jonathan D Schwartz, et al. Neoadjuvant and adjuvant therapy for resectable hepatocellular carcinoma: review of the randomised clinical trials. Lancet Oncol. 2002; 3(10): 593-603. doi: 10.1016/s1470-2045(02)00873-2.
21. Kenta Inomata, et al. Long-term outcomes of living donor liver transplantation after locoregional treatment for hepatocellular carcinoma: an experience from a single institute. Surg Today. 2021; 51(3): 350-357. doi: 10.1007/s00595-020-02095-3.
22. Teh-Ia Huo, et al. Validation of the HCC-MELD for dropout probability in patients with small hepatocellular carcinoma undergoing locoregional therapy. Clin Transplant. 2008; 22(4): 469-75. doi: 10.1111/j.1399-0012.2008.00811.
23. Neil Mehta, et al. Intention to treat outcome of T1 hepatocellular carcinoma with the "wait and not ablate" approach until meeting T2 criteria for liver transplant listing. Liver Transpl. 2016; 22(2): 178-87. doi: 10.1002/lt.24360.
24. Wong Hoi She, et al. Bridging and downstaging therapy in patients suffering from hepatocellular carcinoma waiting on the list of liver transplantation. Transl Gastroenterol Hepatol. 2016; 1: 34. doi: 10.21037/tgh.2016.03.04.