QUẢN LÝ BIẾN CỐ BẤT LỢI LIÊN QUAN ĐẾN MIỄN DỊCH CỦA THUỐC ỨC CHẾ ĐIỂM KIỂM SOÁT MIỄN DỊCH TRONG ĐIỀU TRỊ UNG THƯ
ThS.DS. Nguyễn Thị Hà, GS.TS. Mai Trọng Khoa, PGS.TS. Phạm Cẩm Phương
Trung tâm YHHN&UB, Bệnh viện Bạch Mai
(Bài tổng hợp)
Sự ra đời của thuốc ức chế điểm kiểm soát miễn dịch (ICI: Immune Checkpoint Inhibitors) đã đánh dấu một kỷ nguyên mới trong điều trị ung thư, cho phép kéo dài thời gian sống thêm trên bệnh nhân ung thư đã di căn và cung cấp các chỉ định điều trị mới ở giai đoạn đầu. Tuy nhiên, việc sử dụng phổ biến liệu pháp này dẫn đến xuất hiện các biến cố bất lợi liên quan đến miễn dịch (irAEs: Immune-Related Adverse Events), trở thành một trở ngại lớn trong điều trị. Bài viết sau đây sẽ cung cấp các thông tin tổng quan về thuốc ức chế điểm kiểm soát miễn dịch cũng như các biện pháp quản lý các irAEs thường gặp.
1. Giới thiệu thuốc ức chế điểm kiểm soát miễn dịch
1.1. Định nghĩa
Hệ thống miễn dịch có các điểm kiểm soát miễn dịch giúp điều hòa hoạt động miễn dịch. Thuốc ức chế điểm kiểm soát miễn dịch là các kháng thể đơn dòng nhắm vào các thụ thể trên bề mặt tế bào tham gia vào quá trình miễn dịch như lympho B, lympho T (CTLA-4, PD-1: Cytotoxic T-lymphocyte associated protein 4, Programmed cell death protein 1) hoặc phối tử của nó (PD-L1 và PD-L2: Programmed death-ligand 1, Programmed death-ligand 2), qua đó kích thích khả năng phòng vệ tự nhiên của cơ thể để chống lại ung thư [1].
Bảng 1: Một số thuốc ICI được phê duyệt [2]
| Thuốc | Tên thương mại | Đích tác dụng | FDA phê duyệt (năm) |
| Ipilimumab | Yervoy | CTLA-4 | 2011 |
| Nivolumab | Opdivo | PD-1 | 2014 |
| Pembrolizumab | Keytruda | PD-1 | 2014 |
| Atezolizumab | Tecentriq | PD-L1 | 2016 |
| Avelumab | Bavencio | PD-L1 | 2017 |
| Durvalumab | Imfinzi | PD-L1 | 2017 |
| Cemiplimab | Libtayo | PD-1 | 2018 |
| Tremelimumab | Imjudo | CTLA-4 | 2022 |
1.2. Cơ chế tác dụngHình 1: Cơ chế tác dụng của thuốc ICI thông qua thụ thể CTLA-4 và PD-1
Cơ chế tác dụng của ICI thông qua thụ thể CTLA-4: Kháng nguyên do MHC trình diện sẽ liên kết với thụ thể của tế bào T, CD28 trên tế bào T liên kết với B7 trên tế bào trình diện kháng nguyên và kích hoạt tế bào T. CTLA-4 sau đó được tế bào T biểu hiện và cạnh tranh để liên kết với B7. Không giống như CD28, CTLA-4 gửi tín hiệu ức chế đến tế bào T, ngăn chặn tế bào T tiêu diệt tế bào ung thư. Kháng thể kháng CTLA-4 sẽ chặn tín hiệu ức chế đó.
Cơ chế tác dụng của ICI thông qua thụ thể PD-1: Các tế bào T được kích hoạt, đặc biệt là tế bào T CD8+ gây độc tế bào, tìm kiếm mục tiêu khối u trong các mô và liên kết với các kháng nguyên bề mặt do MHC trình diện thông qua thụ thể trên bề mặt tế bào T. Sau đó, PD-1 được biểu hiện trên bề mặt tế bào T. Khi PD-1 liên kết với PD-L1 trên tế bào đích, nó sẽ gửi tín hiệu ức chế đến tế bào T, tắt khả năng gây độc tế bào. Các kháng thể chống lại PD-1 trên tế bào T hoặc PD-L1 trên tế bào khối u sẽ chặn con đường ức chế này [1].
2. Biến cố bất lợi liên quan đến miễn dịch của ICI
2.1. Loại biến cố và thời gian khởi phát
Thời gian khởi pháp irAEs khó dự đoán ở hầu hết các cơ quan và một số cơ quan nhất định bị ảnh hưởng hơn cơ quan khác. ICI thường liên quan đến các biến chứng bệnh tự miễn như phát ban, viêm đại tràng, viêm gan, và rối loạn nội tiết,...Phát ban thường xuất hiện đầu tiên, trong vòng 2 đến 4 tuần sau khi bắt đầu điều trị, sau đó là tiêu chảy/viêm đại tràng, xuất hiện sau liều thứ 1 – 3 của tuần điều trị thứ 6, tiếp đến nhiễm độc gan, thường xuất hiện sau liều thứ 3 – 4 ở tuần điều trị thứ 8 - 12, bệnh nội tiết thường xảy ra vào giữa tuần điều trị thứ 12 đến tuần 24. Các biến cố có thể xảy ra sớm nhất là một ngày sau liều đầu tiên cho đến 1 năm sau khi ngừng điều trị [3].
2.2. Mối liên quan irAE với yếu tố tiên lượng khi sử dụng ICI
Trong một số trường hợp, irAEs có thể dẫn đến rối loạn chức năng vĩnh viễn, bệnh nhân có thể không hồi phục sau tác dụng phụ, đồng thời làm hạn chế việc điều trị lại bằng ICI. Tuy nhiên, một số nghiên cứu gần đây đã báo cáo mối quan hệ tích cực giữa irAE và hiệu quả lâm sàng ở bệnh nhân ung thư về tỷ lệ đáp ứng, PFS và OS.
Trong một nghiên cứu trên những bệnh nhân NSCLC tiến triển có sử dụng ICI nhóm ức chế PD-1, cho thấy sự hiện diện của irAE như một yếu tố tiên lượng OS và PFS cao hơn (đáng chú ý OS trung bình ở bệnh nhân gặp irAEs là 20,5 tháng so với 8,5 tháng, bất kể loại irAE nào).
Dữ liệu tương tự đã được quan sát thấy trong các nghiên cứu tại Châu Á, Pháp, Canada,... trên nhiều loại ung thư khác nhau như ung thư hắc tố, ung thư vùng đầu cổ, ung thư đường tiêu hóa. Cuối cùng, một phân tích tổng hợp bao gồm hầu hết các nghiên cứu có liên quan về các loại khối u khác nhau đã chứng minh mối liên hệ tích cực giữa irAE và khả năng sống sót, bất kể vị trí của khối u nguyên phát, loại ICI và irAE [4].
2.3. Tỉ lệ mắc phải
Mức độ nghiêm trọng và tần suất của irAE phụ thuộc vào loại ung thư, thuốc sử dụng nhắm PD-1/PD-L1 hoặc CTLA-4, điều trị đơn trị liệu hay kết hợp (tỷ lệ mắc irAE với liệu pháp kết hợp thường cao hơn). Hầu như tất cả bệnh nhân đều gặp phải một số dạng irAE, nhưng irAE cấp độ 3-4 thường xảy ra ở khoảng 55% bệnh nhân sử dụng phối hợp, 27,3% bệnh nhân sử dụng ICI nhóm ức chế CTLA-4, 16,3% bệnh nhân sử dụng ICI nhóm ức chế PD-1 [5].
Hình 2: Tổng quan các tác dụng phụ của ICI
Ghi chú: Tỷ lệ phần trăm các tác dụng phụ độ 3–4 liên quan đến điều trị bằng thuốc kháng PD-1 biểu thị bằng màu xanh lam, thuốc chống CTLA-4 biểu thị bằng màu đỏ và liệu pháp kết hợp biểu thị bằng màu tím.
3. Quản lý các irAEs thường gặp
3.1. irAEs trên da
Đây là irAE phổ biến nhất (>50% ở tất cả các cấp độ), hiếm khi nghiêm trọng và thường không ảnh hưởng đến việc tiếp tục điều trị. Biểu hiện lâm sàng rất đa dạng và không đặc hiệu, trong đó phát ban dát sẩn là phổ biến nhất. Các biểu hiện giống tự miễn như phản ứng lichenoid, bệnh vẩy bến và bệnh da bọng nước. Ngứa cũng có thể là biểu hiện duy nhất của AE trên da, bao gồm cả pemphigoid bọng nước. Ngoài ra, các AE nghiêm trọng, hiếm gặp, có thể gây tử vong như hội chứng Lyell, hội chứng Stevens – Johnson nặng, phản ứng thuốc với tăng bạch cầu ái toan và hội chứng toàn thân (DRESS),... Cách thức xử trí dựa trên mức độ nặng của irAEs, cụ thể như sau [6]:
Hình 3: Quản lý irAE phát ban dát sẩn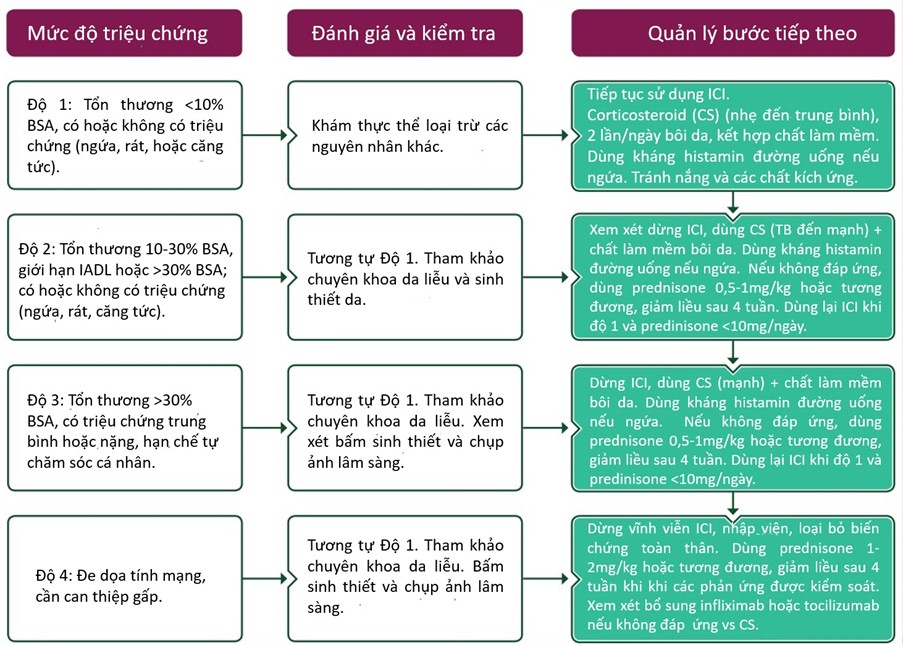
3.2. irAEs nội tiết
Suy tuyến giáp nguyên phát là irAEs nội tiết phổ biến và có thể xảy ra sau tình trạng cường giáp (ít phổ biến hơn). Ngoài ra các irAEs nội tiết khác như rối loạn tuyến yên, đái tháo đường, suy tuyến thượng thận nguyên phát,... Liệu pháp ICI có thể được tiếp tục dùng trong hầu hết các trường hợp, hiếm khi cần CS liều cao. Cách thức xử trí dựa trên mức độ nặng của irAEs, cụ thể như sau [6]:
Hình 4: Quản lý irAE liên quan đến rối loạn giáp trạng
3.3. irAEs trên đường tiêu hóa
Các độc tính trên đường tiêu hóa có thể gặp như viêm đại tràng với các triệu chứng điển hình như đau bụng, tiêu chảy (đây là ir AE đường tiêu hóa phổ biến nhất), viêm đường tiêu hóa trên với các triệu chứng như nôn, buồn nôn, khó nuốt, nuốt đau, nôn ra máu, đau bụng. Cách thức xử trí dựa trên mức độ nặng của irAEs, cụ thể như sau [6]:
Hình 5: Quản lý irAE viêm đại tràng và tiêu chảy
3.4. irAEs trên gan
Tất cả bệnh nhân sử dụng liệu pháp ICI đều nên được đánh giá transaminase huyết thanh, alkaline phosphatase, bilirubin trước mỗi chu kì điều trị. Viêm gan có thể không có triệu chứng hoặc có biểu hiện sốt, khó chịu vùng bụng, vàng da, chán ăn. Cách thức xử trí dựa trên mức độ nặng của irAEs, cụ thể như sau [6]:
Hình 6: Quản lý irAE nhiễm độc gan
Tài liệu tham khảo:
1. K. K. Chan, A. R. Bass, Autoimmune complications of immunotherapy: pathophysiology and management. BMJ 369, m736 (2020).
2. Y. Wang et al., New developments in the mechanism and application of immune checkpoint inhibitors in cancer therapy (Review). Int J Oncol 63, (2023).
3. M. Morgado, A. Plácido, S. Morgado, F. Roque, Management of the Adverse Effects of Immune Checkpoint Inhibitors. Vaccines 8, 575 (2020).
4. P. Iranzo et al., Overview of Checkpoint Inhibitors Mechanism of Action: Role of Immune-Related Adverse Events and Their Treatment on Progression of Underlying Cancer. Front Med (Lausanne) 9, 875974 (2022).
5. J. Seidel, A. Otsuka, K. Kabashima, Treating tumors with immune checkpoint inhibitors: Rationale and limitations. Trends in Immunotherapy 1, 2 (2017).
6. J. Haanen et al., Management of toxicities from immunotherapy: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up☆. Annals of Oncology 33, 1217-1238 (2022).