Phần 2: Các dược chất phóng xạ dùng trong điều trị miễn dịch phóng xạ2.1. Phát triển và sản xuất các mAb
Các kháng thể đích đã dùng trong RIT phải đạt các tính chất lý tưởng sau:
1. Tính di truyền miễn dịch thấp đối với việc tiêm nhắc lại.
2. Gắn tối ưu của kháng nguyên
3. Thẩm thấu vào khối u tốt.
4. Thải lọc ra khỏi tổ chức bình thường nhanh (đặc biệt là tập trung vào khối u đích cao và đặc hiệu, giảm thiểu chiếu xạ ở tổ chức bình thường).
5. Thời gian lưu lại ở khối u tối ưu để phân bố tốt liều chiếu xạ điều trị khối u.
6. Dính chặt tối ưu vào khối u.
Các công trình nghiên cứu đầu tiên về ghi hình và điều trị miễn dịch phóng xạ hầu hết được tiến hành với các kháng thể đa dòng làm từ động vật, thiếu tính đặc hiệu. Sự phát triển của kỹ thuật hybridoma đã sản xuất được mAbs đặc hiệu với đích nhưng vẫn còn chưa được thoả mãn vì 3 lý do chính là:
1. Tính di truyền miễn dịch có nguồn gốc từ chuột của mAbs làm hạn chế việc đưa vào bệnh nhân một hoặc hai vòng.
2. Không cải thiện đáng kể sự hấp thụ vào khối u vì số lượng vị trí gắn trong khối u bị hạn chế.
3. Dược động học kém đối với việc sử dụng hiệu quả trong điều trị RIT (Goldenberg 2002).
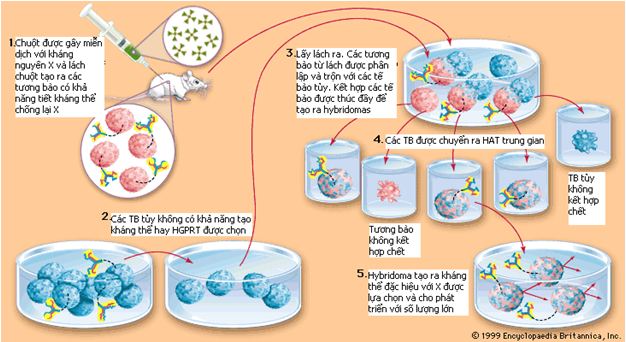
Chiến lược phát triển để cải thiện dược động học để nâng cao hiệu quả điều trị RIT là sử dụng các phân tử nhỏ hơn để thanh lọc nhanh hơn và thẩm thấu vào khối u tốt hơn. Người ta đã nghiên cứu trên động vật thực nghiệm các phân tử và các mảnh nhỏ gắn phóng xạ dùng trong điều trị và đã có hiệu quả cao. Đó là các mảnh F (ab)2 hoá trị 2 và Fab’ hoá trị 1, chúng đều thuộc các phân tử loại này. Các diabody khác nhau (Mr 55.000) và minibody có trọng lượng phân tử cao hơn có độ thanh thải ở thận nhanh đã được kiến tạo với mục đích gắn kết nhiều hơn 2 phân tử kháng nguyên mà vẫn duy trì tính chất thanh thải nhanh ra khỏi cơ thể. Tuy nhiên, trong cải tiến này độ hấp thụ vào khối u so với ngoài u có giá trị ái lực thấp hơn và giảm thời gian lu lại ở khối u dẫn đến độ tập trung tuyệt đối vào u thấp hơn so với các globulin miễn dịch (IgG) còn nguyên vẹn. Hiện nay, cấu trúc của các phân tử nhỏ này đang được sử dụng trong chiến lược tiền đích (pretargeting) với ý tưởng tách đích u ra khỏi sự phân phối các hạt nhân phóng xạ dùng trong điều trị và sẽ được bàn kỹ sau này. Các diabodies và minibodies này cũng đã tìm thấy cách sử dụng hiệu quả trong đánh giá sinh động học của một số thuốc nhất định và một số dược chất đánh dấu dùng trong PET và trong ghi hình miễn dịch phóng xạ đối với một số loại ung thư khi sử dụng gamma camera (SPECT). Các mảnh Fab’ được gắn phóng xạ 68Ga trong theo dõi trastuzumab biểu hiện Her 2 (2004) và trong sử dụng dimer scFv đánh dấu 123I có ái lực đặc hiệu đối với fibronectin extradomain B mà nó có biểu hiện trong hệ máu tân sinh của khối u. Liệu các mảnh và mảnh nhỏ của các kháng thể có vai trò gì trong RIT hay không còn là vấn đề cần phải nghiên cứu tiếp tục trên động vật.
Các kháng thể và các mảnh kháng thể đã được dùng trong RIT và các tính chất nổi bật của chúng được chỉ ra trong bảng 1.
Bảng 1: Các tính chất chính của các mảnh kháng thể và các kháng thể đơn dòng thường dùng
Tính chất | IgG | Fab’ | F(ab)2 | scFv | Diabody |
- Sinh học: + Khả năng gây ra đáp ứng miễn dịch + Bán huỷ trong máu + Cơ quan đích | Có 2 – 3 ngày Gan | Không 4 giờ Thận | Không 1 – 2 ngày Gan | Không 1 giờ Thận | Không < 4 giờ Thận |
- Vật lý: Khối lượng phân tử | 150 K | 50 K | 100 K | 40 K | 20 K |
- Gắn kết u: + Thời gian tăng tốc tối u + Khoảng thời gian + Tập trung | ngày ++++ ++++ | giờ +++ +++ | ngày ++ ++ | giờ + + | giờ +++ +++
|
Việc xuất hiện tính kháng nguyên sau khi đưa lại mAbs vào cơ thể đã được khắc phục bằng cách phát triển các kháng thể đã chimerized, humanized và hoàn toàn của người. Trong từng bước phát triển, mAbs chuột đầu tiên được chuyển thành thể ghép chuột/người tiếp theo được làm thành các kháng thể người đã ghép với CDR của chuột và cuối cùng là các kháng thể người hoàn toàn. Hầu hết các thực nghiệm lâm sàng đã dùng các kháng thể CDR- grafted và chimeric. Các kết quả đã cho thấy chúng có ít tính kháng nguyên so với thế hệ mAbs trớc.Các nghiên cứu sau này giải quyết trực tiếp nguồn gốc ưu thế của ba loại này. Các kháng thể chimeric này đã có đáp ứng miễn dịch. Hy vọng rằng các kháng thể hoàn toàn người có thể sinh ra đáp ứng miễn dịch phụ thuộc tế bào T hoặc kháng di truyền (anti-idiotype).
Một trong những vấn đề được quan tâm nhất và bắt buộc tuân thủ ở hầu hết các nước phát triển trong sự phát triển và nghiên cứu lợi ích ứng dụng của các mAb là sự thực hiện quy định về GMP (Good Manufacture Practice). Luật pháp đòi hỏi phải thử tiền lâm sàng và quản lý thử nghiệm lâm sàng, điều này làm tăng giá chi phí vận hành lên nhiều và làm giảm số lượng dự án nghiên cứu. Luật này đòi hỏi sự phát triển và nhận thức về các phương pháp và phương tiện để sử dụng nguồn lực hạn chế đối với việc thiết kế các quy trình sản xuất ra các mAb.
Liệt kê các mAbs (liên hợp và không liên hợp) hiên tại được đồng ý sử dụng trong ung thư trong bảng 2 như sau.
Bảng 2: Các kháng thể đơn dòng đã đợc FDA cho phép sử dụng trong ung thư
Tên thương mại | FDA đồng ý | Nguồn | Dạng và kiểu | Đích | Chỉ định |
Các dạng liên hợp miễn dịch: |
90Y- – Ibritumomab tiuxetan (Zevalin) with rituximab | 2002 | Murine | 90Y – IgG1 | CD 20 | Lymphoma |
Tositumomab và131I-Toxitumomab | 2003 | Murine | 131I – IgG2a | CD 20 | Lymphoma |
Gemtuzumab (Myekotarg) | 2000 | Human mAb, drug dẫn xuất của streptomyces | hIgG4 – cali - cheamicin | CD 33 | Acute myelogenous leukemin |
mAbs không liên hợp: |
Ritumimab (Rituxan) | 1997 | Murine – Human Chimeric | hIgG1 | CD 20 | Lymphoma |
Trastuzumab (Herceptin) | 1998 | Humanized | hIgG1 | HER2/neu | Ung thư vú |
Alemtuzumab (Campath – 1H) | 2001 | Humanized | hIgG1 | CD 52 | Chronic lymphocytic leukemia |
Cetuximab (Erbitux) | 2004 | Murine – Human Chemenic | hIgG1 | EGF receptor | Ung thư trực tràng |
Bevacizumab (Avastin) | 2004 | Murine – Human Chemenic | hIgG1 | VEGF | Ung thu phổi Ung thư trực tràng |
2.2. Hợp chất liên kết miễn dịch phóng xạ (radioimunoconjugation) dùng trong RIT
Các yếu tố sau đây cần chú ý đối với các hạt nhân phóng xạ khi liên kết với mAbs để điều trị RIT có hiệu quả:
1. Các tính chất lý và hoá học
2. Bản chất của các tia phóng xạ
3. Số phận của các hạt nhân phóng xạ sau khi chuyển hoá kháng thể in vivo
4. Nhu cầu có các phương pháp đơn giản, hiệu quả để sản xuất trong thương mại đối với các liên kết miễn dịch phóng xạ (radioimunoconjugation). Một số tính chất liên quan đến lâm sàng của các hạt nhân phóng xạ dùng trong RIT được dẫn ra trong bảng 3.
Bảng 3: Các hạt nhân phóng xạ hiện đang dùng trong RIT
Hạt nhân phóng xạ | T1/2 (giờ) | Bức xạ điều trị | Emax (keV) | Quãng chạy tối đa (mm) |
131I | 193 | b | 610 | 2,0 |
90Y | 64 | b | 2.280 | 12,0 |
177Lu | 161 | b | 496 | 1,5 |
186Re | 91 | b | 1.080 | 5,0 |
188Re | 17 | b | 2.120 | 11,0 |
67Cu | 62 | b | 577 | 1,8 |
211At | 7,2 | a | 7.450 | 0,08 |
212Bi | 1 | a | 8.780 | 0,09 |
213Bi | 0,77 | a | > 6.000 | < 0,1 |
125I | 1.442,4 | Các điện tử năng lượng thấp | 350 | 0,02 |
67Ga | 79,2 | Các điện tử năng lượng thấp | 180 | 0,02 |
Để đa liều tiêu diệt các tế bào ung thư có hiệu quả cần phải chọn lựa dùng các hạt alpha, hạt beta hay các điện tử Auger (năng lượng thấp). Phải chú ý rằng hiệu quả của RIT phụ thuộc không chỉ vào các tính chất của hạt nhân phóng xạ và các mAb mà còn phụ thuộc vào độ nhạy cảm của loại khối u, vị trí của nó, kích thước, tính sinh lý, mô bệnh học và độ nhạy cảm phóng xạ đối với các hạt nhân phóng xạ. Phải có sự tương quan phù hợp giữa liều lượng phóng xạ trong tổ chức bình thường và mô khối u để giảm thiểu sự độc hại đối với liều tiêu diệt bệnh.
Có 2 hạt nhân phóng xạ được dùng nhiều nhất trong RIT là 90Y và 131I đều phát tia beta. Các hạt nhân phát tia beta khác cũng bắt đầu được dùng trong RIT là 177Lu, 67Cu, 186Re và 188Re.
Các hạt b có phạm vi rộng hơn về thời gian bán rã và năng lượng tia và độ dài quãng chạy so với các hạt a. Lịch sử đã cho thấy 131I được dùng nhiều nhất trong RIT vì nó luôn có sẵn trong thị trường, giá rẻ, có khả năng ghi hình bằng các camera gamma (và cho khả năng đo liều). Mặt khác, ưu điểm của nó còn có thời gian bán huỷ là 8 ngày và được liên kết với các protein tương đối dễ dàng. Uỷ ban quy phạm hạt nhân Mỹ đã phê duyệt cho dùng 131I vào RIT ngoại trú (Siegel 1998). Nhng bên cạnh các ưu điểm đó , việc sử dụng 131I vào RIT vẫn còn những hạn chế như sự suy giảm chất lượng của các liên kết miễn dịch phóng xạ dẫn đến hậu quả là giảm liều chiếu vào khối u và giảm thời gian lưu lại ở khối u. So với 131I, 90Y phát beta thuần tuý và hạt beta này có năng lượng cao hơn, đi xa hơn trong tổ chức (131I đi đợc 2 mm, 90Y đi đợc 12 mm), do đó phù hợp với chiếu xạ các khối u có kích thước lớn hơn. Một ưu điểm nữa của 90Y là thời gian lưu lại ở khối u lâu hơn. Đánh dấu 90Y với mAbs rất hiệu quả với hiệu suất cao và độ bền vững tốt. Chelator thường đợc sử dụng nhất để đạt được các kết quả đáng khích lệ là hợp chất 1, 4, 7, 10 – tetraazacyclododecane – N, N’, N”, N”’ – tetraacetic acid (DOTA). Liên hợp kháng thể đạt được bởi phản ứng hoạt hoá với N – hydroxy sulfosuccinimide (Govindan 1998).
Việc sử dụng các hạt a cho RIT là tương đối mới nhng đã cho thấy có nhiều kết quả hứa hẹn. Việc phát triển các generator 234Ra và 225Ac để sản xuất ra 212Bi và 213Bi phát ra các hạt a có hiệu suất cao đã mở rộng khả năng gắn với các mAb (Sgouros 1999). Các hạt nhân khác phát a là 211At, được sản xuất từ gia tốc vòng, cũng đã được sử dụng trong RIT. Các hạt nhân phát tia a này có giá trị LET cao ( ~ 1000 keVmm) và đi trong tổ chức rất ngắn (< 0,1 mm). Khả năng phát bức xạ có LET cao vào một đoạn rất ngắn trên ADN, dẫn đến đứt gãy từng phần, đã là lý do chính để quan tâm đến cải tiến này. Một trong những yêu cầu đầu tiên đối với những hạt nhân phóng xạ phát a dùng trong RIT là phải có các phơng pháp liên kết với mAb thật nhanh bởi vì chúng có đời sống rất ngắn. Hầu hết phương pháp gắn được sử dụng hiện nay chỉ mất ít hơn 2 giờ mà vẫn còn chưa thoả mãn. Các hạt nhân phóng xạ này được sử dụng điều trị tốt nhất cho các ổ di căn rất nhỏ (micro metastases) hoặc cho tuần hoàn của các tế bào u. Các hạt nhân phát điện tử năng lượng thấp như 125I cũng đang được sử dụng ngày càng tăng trong RIT.
PGS.TS. Mai Trọng Khoa, PGS.TS. Trần Xuân Trường
Trung tâm YHHN&UB, Bệnh viện Bạch Mai và ĐH Y Hà Nội