Kỷ nguyên mới của liệu pháp Gen và tế bào đối với Ung thư
Lưu Đức Long
Đại học Y Hà Nội;
Trung tâm Y học hạt nhân và Ung bướu - Bệnh viện Bạch Mai.
(dịch)
Một nghiên cứu đánh giá triển vọng nghiên cứu và ứng dụng của liệu pháp tế bào gốc trung mô (MSC: Mesenchymal stem cells) đang nổi lên như một loại thuốc tế bào tiềm năng và có giá trị, có thể được áp dụng thành công trong bệnh ung thư, các bệnh tự miễn và các bất thường về mô hoặc cơ quan khác nhau trong tương lai.
Một nhóm các nghiên cứu viên đã thống kê các tài liệu nghiên cứu được công bố về liệu pháp gen và tế bào cho đến tháng 8 năm 2022. Kết quả cho thấy rằng hiệu quả điều trị của tế bào gốc trung mô biến đổi gen (EMSC: engineered mesenchymal stem cells) trong các bệnh ác tính, đặc biệt là khối u rắn, đã được nghiên cứu rộng rãi và các thử nghiệm lâm sàng liên quan đang dần được thực hiện.
Tại Trung Quốc, các thử nghiệm lâm sàng liên quan tới MSC có nguồn gốc từ dây rốn ở người (hUC-MSC: the human umbilical cord-derived MSC) chiếm hơn 50% (18/34) các thử nghiệm về thuốc MSC điều trị các bệnh về ung thư.
Hình 1. Tiến trình và ứng dụng của các thử nghiệm lâm sàng đối với các loại thuốc liên quan đến MSC đã được Trung tâm đánh giá thuốc (CDE: the National Center for Drug Evaluation) phê duyệt tại Trung Quốc. (A): Tiến trình chủ yếu diễn ra trong các thử nghiệm giai đoạn I và II. (B): Có 34 thử nghiệm đăng ký nghiên cứu thuốc mới dành cho MSC.
Tại Hoa Kỳ, sự phát triển thành công của tế bào CAR-T (chimeric antigen receptor T cells) báo trước sự xuất hiện của kỷ nguyên thuốc gen và tế bào cũng như phương pháp chữa trị khối u. Liệu pháp tế bào CAR-T đã tạo ra những kết quả trong điều trị một số bệnh ác tính về huyết học. Những bệnh nhân đầu tiên mắc bệnh bạch cầu tế bào B tái phát hoặc kháng trị được điều trị bằng tế bào CAR-T nhắm mục tiêu CD19 đã cho thấy phản ứng thuận lợi. Vì vậy, liệu pháp tế bào CAR-T mang lại sự lạc quan ở một số bệnh nhân có khối u ác tính về huyết học tái phát và khó chữa. Liệu pháp tế bào CAR-T đã được FDA phê duyệt vào năm 2017 để điều trị TẤT CẢ và điều trị ung thư hạch tế bào B lớn lan tỏa ở Hoa Kỳ. FDA cũng đã nhận được sự chấp thuận cho việc sử dụng liệu pháp tế bào CAR-T để điều trị ung thư hạch tế bào vỏ vào năm 2020 và đa u tủy vào năm 2021. Tuy nhiên, hầu hết bệnh nhân có khối u ác tính tế bào B được phát hiện tái phát trong vòng 1 đến 2 năm sau khi điều trị bằng tế bào CAR-T. Các cơ chế phổ biến liên quan đến tái phát sau điều trị bằng tế bào CAR-T bao gồm mất kháng nguyên khối u, cạn kiệt tế bào T và ức chế miễn dịch của vi môi trường khối u (TME). Hơn nữa, có nhiều trở ngại ngăn cản việc sử dụng liệu pháp miễn dịch tế bào CAR-T trong điều trị khối u rắn. Do đó, việc nghiên cứu các loại thuốc gen và tế bào hiệu quả hơn để điều trị ung thư, đặc biệt đối với các khối u rắn, là rất cần thiết và MSC có thể là một lựa chọn lý tưởng.
Trên lâm sàng, khoảng 90% bệnh nhân ung thư chết vì di căn khối u. Vì vậy, việc ngăn ngừa di căn là điều cần thiết để kéo dài sự sống cho bệnh nhân. Ngăn chặn sự xuất hiện và di căn của khối u là chiến lược kinh tế và hiệu quả nhất. Viêm có vai trò quan trọng trong các giai đoạn phát triển khối u khác nhau, bao gồm giai đoạn khởi đầu, giai đoạn phát triển, giai đoạn biến đổi khối u, giai đoạn xâm nhập và di căn của nguyên nhân khối u. Ngoài ra, tình trạng viêm ảnh hưởng đến việc giám sát miễn dịch và phản ứng với liệu pháp điều trị khối u. Tác dụng chống viêm của MSC cho thấy tiềm năng ngăn chặn sự hình thành khối u và di căn. hUC-MSC đã được báo cáo là có tác dụng ức chế sự hình thành khối u bằng cách giảm tỷ lệ đại thực bào ở chuột bị ung thư ruột kết. MSC được tiêm tĩnh mạch có thể được phát hiện trong mô khối u, cho thấy sự hình thành di căn phổi bị ức chế ở chuột và cơ chế có thể là sự tương tác trực tiếp giữa MSC và tế bào ung thư thông qua các yếu tố hòa tan. Vì MSC có thể xâm nhập vào các vị trí của khối u và di căn nên chúng có thể được sử dụng như “con ngựa thành Troy của tế bào” để vận chuyển các yếu tố chống ung thư vào TME tại các vị trí của khối u và di căn (Hình 2). Hơn nữa, MSC có thể được biến đổi về mặt di truyền và các thành phần được biểu hiện bởi EMSC có thể gây ra tác dụng chống tăng sinh, tăng quá trình chết tế bào và chống tạo mạch. Bên cạnh những tác dụng này, MSC có thể được sửa đổi để biểu hiện các cytokine (tức là siêu họ yếu tố hoại tử khối u, interferon và interleukin) có thể làm tăng khả năng miễn dịch của khối u nội sinh và ức chế hiệu quả sự tăng trưởng, phát triển và di căn của khối u. Ngoài ra, bằng cách phủ hoặc thông qua các kháng thể kỹ thuật di truyền, MSC có thể biểu hiện kháng thể một cách ổn định và liên tục chống lại các phối tử đặc hiệu của khối u đối với locus khối u, có thể ức chế sự phát triển của khối u và tiêu diệt tế bào khối u. Hơn nữa, MSC cũng có thể được thiết kế để mang các gen tự sát nhằm tạo ra các chất độc hại đặc biệt ức chế sự phát triển của khối u trong khi vẫn giữ lại các mô bình thường xung quanh khối u. Hơn nữa, MSC có thể cung cấp microRNA chống ung thư trị liệu (miRNA) để ức chế sự hình thành mạch, sự phát triển, di căn và kháng hóa trị của khối u. Ngoài ra, MSC có thể được sử dụng làm phương tiện vận chuyển các loại thuốc hóa trị thông thường có tác dụng chống ung thư và vi-rút oncolytic có thể tiêu diệt tế bào ung thư một cách có chọn lọc. Quan trọng hơn, MSC có thể được chuyển đổi thành các tế bào trình diện kháng nguyên mạnh (APC) bằng kỹ thuật di truyền để biểu hiện phức hợp immunoproteasome hoặc bằng phương pháp dược lý sử dụng UM171A hoặc tranylcypromine, có thể ức chế đặc hiệu lysine. demethylase 1 (LSD1) trong MSC. Những yếu tố này thúc đẩy các đặc tính giống APC có thể có lợi cho việc thiết kế các loại vắc xin chống ung thư phổ biến dựa trên MSC.
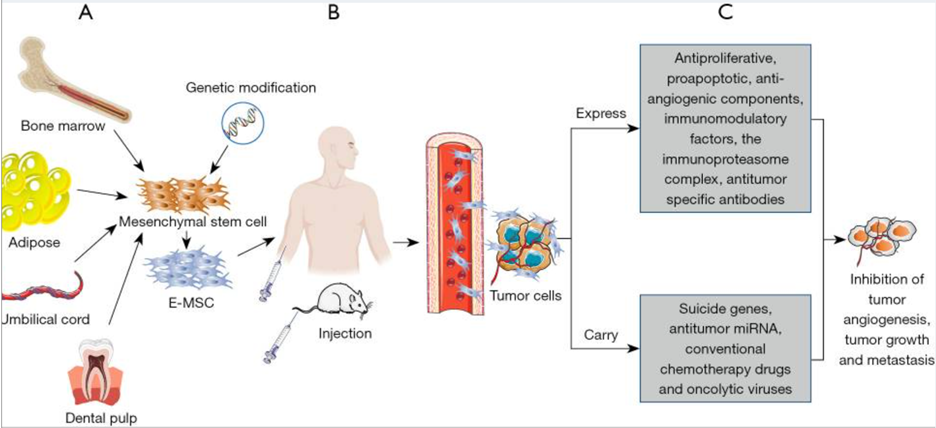
Hình 2. Sơ đồ nguồn, sửa đổi kỹ thuật và cơ chế chống ung thư của tế bào gốc trung mô.
Hơn nữa, MSC có thể thúc đẩy quá trình sửa chữa mô và cơ quan, cải thiện môi trường vi mô cục bộ của khối u và ngăn ngừa tái phát khối u, điều này có thể khắc phục một số trở ngại của liệu pháp tế bào CAR-T trong điều trị khối u rắn. Do đó, EMSC có tiềm năng lớn cho các ứng dụng lâm sàng trong điều trị ung thư.
Cho đến nay, rất ít thử nghiệm lâm sàng về EMSC được biến đổi bởi virus hoặc không phải virus đã được tiến hành đối với các bệnh khác nhau. Nghiên cứu lâm sàng đầu tiên về việc sử dụng EMSC trong điều trị khối u rắn, được báo cáo vào năm 2010, đã sử dụng virus oncolytic toàn thân được cung cấp bởi MSC tủy xương tự thân để điều trị u nguyên bào thần kinh di căn. Một phần tư số bệnh nhân đạt được đáp ứng hoàn toàn sau hơn 4 năm kể từ khi chẩn đoán (36 tháng sau lần điều trị đầu tiên), đây là lần đầu tiên bệnh nhân mắc u nguyên bào thần kinh giai đoạn IV đạt được đáp ứng hoàn toàn trong 20 năm kinh nghiệm điều trị u nguyên bào thần kinh của người nghiên cứu. Vào năm 2019, một thử nghiệm lâm sàng khác, thử nghiệm điều trị giai đoạn I–II đối với các khối u tiến triển bằng tế bào trung mô 1 (TREAT-ME-1), tập trung vào các MSC được biến đổi bởi virus herpes simplex thymidine kinase (HSV-TK) chống lại các khối u đường tiêu hóa tiến triển với hệ thống liệu pháp gen tự sát, đã đánh giá tính an toàn và khả năng dung nạp của MSC tự thân chuyển gen kết hợp với ganciclovir chống lại ung thư biểu mô tuyến đường tiêu hóa tiến triển và cho thấy hiệu quả sơ bộ của liệu pháp này trong việc ổn định bệnh trên lâm sàng. Trong thử nghiệm lâm sàng mới nhất, được công bố vào năm 2020, các MSC tự thân mang vi rút gây ung thư Icovir-5 có tên là Celyvir, một loại thuốc trị liệu tiên tiến dành cho những bệnh nhân có khối u tiến triển, đã được sử dụng để điều trị các bệnh ác tính. Nghiên cứu không tìm thấy độc tính cấp độ 2 đến 5, điều này cho thấy sự kết hợp giữa MSC và adenovirus oncolytic là an toàn. Hơn nữa, bệnh đã ổn định ở 2 bệnh nhân u nguyên bào thần kinh. Mặc dù cần có các giai đoạn thử nghiệm lâm sàng tiếp theo nhưng EMSC cung cấp một lựa chọn có giá trị cho một số bệnh nan y trong tương lai.
Nguồn: Lihua Wang, Guangyang Liu, Libo Zheng, Haomiao Long, and Yongjun Liu (2023). A new era of gene and cell therapy for cancer: a narrative review. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10316111