CN. Võ Thị Thúy Quỳnh (dịch và lược dịch)
Đơn vị Gen – Tế bào gốc, Trung tâm Y học hạt nhân và Ung bướu, Bệnh viện Bạch Mai
Trong những năm gần đây đã có những tiến bộ lớn trong việc điều trị các khối u ác tính, như sử dụng tế bào T được thiết kế (engineered T-cell), hay được gọi là tế bào T mang thụ thể kháng nguyên dạng khảm (chimeric antigen receptor T-cell).
Cơ sở sinh học cho việc sử dụng liệu pháp tế bào CAR T
Điều đầu tiên cần hiểu tại sao chúng ta cần thiết kế tế bào CAR T để tiêu diệt khối u? Nguyên tắc của liệu pháp tế bào CAR là biến đổi một tế bào T riêng lẻ biểu hiện trên bề mặt tế bào của nó một thụ thể sẽ dẫn đến sự nhận biết của tế bào đích và kích hoạt tế bào T để phá hủy khối u.
Có thể thấy, một thụ thể kháng nguyên dạng khảm được cấu tạo trên miền tế bào phụ của một đoạn được gọi là đoạn biến đổi chuỗi đơn (single-chain variable fragment - scFv), cho phép nhận biết đặc hiệu kháng nguyên trên tế bào khối u (tumor cell). Sau đó, có một miền xuyên màng (transmembrane region) liên kết. Bên trong tế bào là một số miền tín hiệu quan trọng dẫn đến sự tăng sinh, kích hoạt và tồn tại của các tế bào CAR T khi chúng có sự nhận diện với các tế bào khối u.
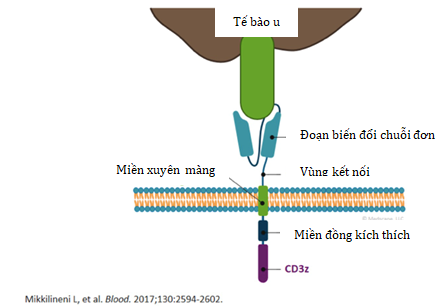
Hình 1. Cấu tạo của tế bào CAR-T
Trước tiên, thu hoạch tế bào T từ bệnh nhân và làm cho chúng biểu hiện CAR này vĩnh viễn thông qua sự tải nạp lentillin hoặc retrovirus. Sau đó, các tế bào sẽ được truyền cho bệnh nhân. Nhanh chóng sau khi tiêm truyền, chúng sẽ sinh sôi nảy nở làm tăng số lượng tế bào CAR T 10.000 đến 100.000 lần. Điều này do thực tế là tế bào CAR T này sẽ gặp phải các tế bào khối u mang kháng nguyên được nhận diện. Khi các tế bào CAR tăng sinh và được kích hoạt, chúng sẽ hoạt động gây độc tế bào để tiêu diệt các tế bào khối u có trong cá thể. Điều quan trọng là hiệu quả ngay lập tức của tế bào CAR T này cho phép thu nhỏ khối u, nhưng cũng tồn tại nhiều tháng, hoặc nhiều hơn, để tránh sự hồi sinh của tiền thân các khối u có cùng kháng nguyên. Đây là một nguyên tắc chung của liệu pháp tế bào CAR.

Hình 2: Cơ chế hoạt động của tế bào CAR-T
Thông thường bệnh nhân được tiến hành thu lấy bạch cầu các tế bào đơn nhân và chuyển đến nơi sản xuất. Tại đây, các tế bào sẽ được xử lý và tinh sạch chúng. Sau đó, họ sẽ biến nạp gen mã hóa CAR bằng cách sử dụng các virus đã được sửa đổi; tăng sinh các tế bào và cất đông chúng.
Tại thời điểm này, nó trở thành một sản phẩm được sản xuất, được coi là một loại thuốc. Sản phẩm này sẽ được chuyển trở lại bệnh viện nơi điều trị bệnh nhân. Một trong những nguyên tắc của việc sử dụng tế bào CAR-T là trước khi sử dụng các tế bào CAR-T này, chúng ta cần làm suy giảm tế bào lympho của người nhận. Để làm được điều đó, chúng tôi thường sử dụng hóa trị làm suy giảm lympho, thường bao gồm sự kết hợp của cyclophosphamide và fludarabine.

Hình 3. Quy trình tạo ra tế bào CAR T
Liệu pháp CAR T trong thực hành lâm sàng trên u lympho không Hodgkin
Hiện tại, 2 sản phẩm tế bào CAR được Hiệp hội Dược phẩm Hoa Kỳ (FDA) phê chuẩn tại Hoa Kỳ và châu Âu cho u lympho không Hodgkin (Non-Hodgkin Lymphoma – NHL) tái phát hoặc khó chữa. Cụ thể, điều kiện bệnh nhân trải qua điều này khi bị tái phát hoặc khó chữa với ít nhất 2 phác đồ điều trị và có u lympho tế bào B lớn khuếch tán (diffuse large B-cell lymphoma - DLBCL), không nhận chỉ định khác. U lympho tế bào B độ cao, u lympho nang biến đổi (follicular lymphoma - FL) hoặc u lympho tế bào B trung thất nguyên phát. Hai sản phẩm được đề cập gọi là axicabtagene ciloleucel hoặc axi-cel và tisagenlecleucel hoặc tisa-cel. Cả axi-cel và tisa-cel đều là các sản phẩm tế bào CAR chống CD19 hướng cho các u lympho tế bào B tái phát và khó chữa. Có sự khác biệt nhỏ trong các sản phẩm này, đáng chú ý nhất là miền hoạt động. Axi-cel sử dụng miền CD28 trong khi tisa-cel sử dụng miền 41BB.
Axicabtagene ciloleucel đã được FDA chấp thuận dựa trên thử nghiệm ZUMA-1 pha 2. Trong thử nghiệm đó, 111 bệnh nhân với độ tuổi trung bình là 58. Tất cả các bệnh nhân trong nghiên cứu này không đạt được đáp ứng với những liệu pháp trước đó hoặc đã tái phát sau chưa đầy 1 năm sau khi ghép tế bào gốc tự thân (stem-cell transplant - SCT).
Kết quả của thử nghiệm này cho thấy tỷ lệ đáp ứng chung là 82% với tỷ lệ thuyên giảm hoàn toàn là 58%. Điều quan trọng là, các đáp ứng này đã được chứng minh là bền vững và hiện chúng tôi có dữ liệu theo dõi 2 năm cho thấy tỷ lệ sống bệnh không tiến triển trung bình (PFS) khoảng 6 tháng, nhưng khoảng 40% bệnh nhân vẫn không có tiến triển trong 2 năm sau đó. Cho thấy độ bền vượt trội và có khả năng chữa khỏi cho bệnh nhân kháng các liệu pháp trước đó.
Tisagenlecleucel đã được nghiên cứu trong thử nghiệm JULIET toàn cầu pha 2 với nhóm bệnh nhân tương tự. Bệnh nhân trong nghiên cứu này cũng đã tái phát u lympho tế bào B sau ít nhất 2 phác đồ điều trị trước đó. Một số khác biệt nhỏ về tính đủ điều kiện cho thử nghiệm này bao gồm bệnh nhân không kháng hóa trị. Ngoài ra, thử nghiệm này không bao gồm u lympho tế bào B trung thất nguyên phát, nhưng bao gồm DLBCL không nhận chỉ định khác, FL biến đổi và u lympho kép và ba lần. Độ tuổi trung bình trong nghiên cứu này là 56 tuổi. Khoảng 27% bệnh nhân có u lympho kép hoặc ba lần và hơn một nửa số bệnh nhân đã chịu được liệu pháp trước đó. Một nửa số bệnh nhân đã thực sự tái phát sau một SCT trước đó. Tỷ lệ đáp ứng trong thử nghiệm này là 52% với tỷ lệ đáp ứng hoàn toàn tốt nhất là 40%. Như đã được chỉ ra trong nghiên cứu axi-cel, các phản ứng có thể chứng minh độ bền với khoảng một phần ba số bệnh nhân còn lại không tiến triển trong một năm sau đó.
Cũng có các sản phẩm bổ sung hiện đang nổi lên. Bao gồm thử nghiệm TRANSCEND-NHL 001, được trình bày tại Hiệp hội Huyết học Hoa Kỳ (ASH) năm 2019, lisocabtagene maraleucel (liso-cel) trong một quần thể bệnh nhân tương tự với u lympho tế bào B tích cực được điều trị trước. Liso-cel cũng là một sản phẩm tế bào CAR có giá trị chống CD19 41-BB.
Liệu pháp CAR T trong thực hành lâm sàng trên bệnh đa u tuỷ xương
Một trong những phát triển hơn nữa là tế bào CAR T, được định hướng chống lại kháng nguyên BCMA, còn được gọi là kháng nguyên trưởng thành tế bào B. BCMA là một protein thường được biểu hiện trên tất cả các tế bào đa u tuỷ xương (Multiple Myeloma - MM), tất cả các tế bào plasma và thậm chí các tế bào B trưởng thành.
Gần đây trên Tạp chí Y học New England đã công bố, dữ liệu về bb2121. Đây là bước đột phá đầu tiên về việc điều trị bệnh nhân mắc MM. Bb2121 này được định hướng chống lại BCMA. Nó là CAR thế hệ thứ hai và nó sử dụng 41bb làm miền đồng kích thích trong sản phẩm tế bào CAR này. Thời gian trung bình, hoặc PFS trung vị của những bệnh nhân bị tái phát, một khi họ đã nhận được liều hơn 150 triệu tế bào, có PFS trung bình khoảng 11,8 tháng. Các bệnh nhân đang tái phát và tiếp nhận điều trị tế bào CAR-T, họ tồn tại trong khoảng 6 đến 8 tháng điều trị.
Tại ASH năm 2019, có những cách tiếp cận tế bào CAR mới hơn được trình bày, một trong số được gọi là bb21217. Đây là lần lặp lại tiếp theo của bb2121. Ý tưởng của việc sử dụng bb21217 là thử và xem liệu chúng ta có thể cải thiện PFS, mà chúng ta đã thấy với bb2121 hay không. Vậy chúng ta có thể làm gì để cải thiện sự bền bỉ của các tế bào CAR này không? Những gì đã được thực hiện với bb21217, là những CAR này đã được phơi nhiễm in vitro với chất ức chế phosphoinositide 3-kinase (PI3K) có tên BB007, và do đó, tên bb21217, với ý tưởng rằng việc tiếp xúc với chất ức chế PI3K này sẽ thực sự làm giàu cho bộ nhớ kiểu hình tế bào T. Có dữ liệu cho thấy rằng nếu bạn có nhiều kiểu hình tế bào T bộ nhớ, sự bền vững nhiều hơn. Và với sự kiên trì hơn nữa, sẽ tăng PFS hơn nữa.
Có rất nhiều công việc với liệu pháp tế bào cũng xảy ra bên ngoài Hoa Kỳ, ví dụ như ở Trung Quốc. Và có một nghiên cứu rất lớn từ một trung tâm duy nhất ở Trung Quốc. Bây giờ dữ liệu ngoài đó trông rất mạnh mẽ. Có một vài sự khác biệt mà tôi nghĩ chúng ta nên chỉ ra, đó là họ không nhất thiết phải sử dụng fludarabine trong hóa trị liệu cắt bỏ tế bào lympho. Họ đã cho các liều tế bào CAR khác nhau. Truyền dịch, không giống như những gì chúng tôi đã làm, đó là truyền một lần, được truyền trong hơn 2 hoặc 3 ngày. Nó có một chút khác biệt so với các thử nghiệm của Hoa Kỳ.
Sự an toàn của liệu pháp CAR T
Những cân nhắc an toàn chính cho liệu pháp tế bào CAR là gì? Trước hết, đó là một hình thức chuyển hướng của các tế bào T, và do đó có một số vấn đề về giải phóng cytokine. Một trong những cân nhắc an toàn chính là sự xuất hiện và quản lý hội chứng giải phóng cytokine (Cytokine Release Syndrome – CRS), thường xảy ra trong khoảng từ 1 đến tối đa 14 ngày sau khi truyền tế bào CAR. Nó có thể nhẹ, và có một sự khác biệt lớn giữa NHL u tủy. Trong u tủy, chúng ta thấy CRS ít nghiêm trọng hơn nhiều so với điều trị NHL, trong đó một tỷ lệ đáng kể bệnh nhân bị CRS nặng.
Nếu chúng ta thấy CRS drome xảy ra, thường liên quan đến sốt cao, tăng huyết áp, với các bất thường trong phòng thí nghiệm điển hình, thì cách điều trị tại thời điểm này là sử dụng liệu pháp điều trị IL-6, đặc biệt là tocilizumab. Có thể lặp lại điều này, và nếu CRS rất nghiêm trọng, thì phải hỗ trợ lưu thông. Chúng ta phải truyền dịch, cho thuốc vận mạch và được thực hiện trong khu vực chăm sóc đặc biệt (Intensive Care Unit – ICU). Nó thường gặp ở những bệnh nhân mắc NHL so với bệnh nhân mắc MM, điều này có thể là do các tế bào T được lấy từ bệnh nhân u tủy đã cạn kiệt hơn rất nhiều và do đó có lẽ ít có khả năng sản xuất ra cytokine hơn so với bệnh nhân với NHL.
Một vấn đề khác rõ ràng là độc tính thần kinh thường liên quan đến CRS. Ở đây, phương pháp điều trị điển hình là corticosteroid liều cao để thực sự kiểm soát độc tính thần kinh. Một vấn đề nữa là các biến chứng nhiễm trùng, đặc biệt là ở bệnh nhân u tủy, trong đó rất nhiều bệnh nhân u tủy này thực sự phát triển tế bào chất và một số rối loạn chức năng tế bào T, vì vậy chúng tôi thấy các biến chứng nhiễm trùng xảy ra ở bệnh nhân sau khi điều trị bằng tế bào CAR, đặc biệt là ở bệnh nhân đầu tiên 30 ngày sau khi truyền, và chúng tôi thường phải tìm nhiễm trùng do vi khuẩn, những bệnh phổ biến nhất, nhưng cũng là nhiễm virus và nấm. Và ở một số bệnh nhân này, chúng tôi thực sự đã thấy nhiễm trùng cơ hội, vì vậy chúng tôi có một số bệnh nhân sàng lọc một số bệnh nhiễm trùng tương tự như bệnh nhân trải qua SCT dị thân.
Có một số chiến lược bằng cách sử dụng các chất ức chế tyrosine kinase (TKIs), thực sự có thể ức chế tín hiệu, tín hiệu nội bào, và do đó để khắc phục hoặc ngăn chặn CRS, khi có một số vấn đề có thể sử dụng TKIs, ví dụ như dasatinib, mà thực sự có thể can thiệp vào tín hiệu nội bào này vào các tế bào T.
Thực hành sàng lọc bệnh nhân cẩn thận, đặc biệt là chức năng phổi của thận. Và sẽ chỉ nhận một bệnh nhân điều trị bằng tế bào CAR nếu bệnh nhân này cũng phù hợp với SCT tự thân. Bây giờ, làm thế nào để sàng lọc những độc tính này ở những bệnh nhân đã trải qua liệu pháp tế bào CAR? Ở Đức, có các quy tắc rất rõ ràng, bệnh nhân được nhập viện trong 14 ngày và nếu họ phát triển bất kỳ dấu hiệu CRS nặng nào, họ thực sự được nhận vào ICU để hỗ trợ lưu thông.
Bài viết được lược dịch từ bài “CAR T-Cell Therapy in Non-Hodgkin Lymphoma and Multiple Myeloma: A Clinical Update” của Gilles Salles, MD, PhD; Jeremy Abramson, MD; Noopur Raje, MD; Hermann Einsele, MD, PhD được đăng trên Medscape Oncology ngày 21 tháng 3 năm 2020.
nguồn: ungthubachmai.com.vn