CHẨN ĐOÁN HOẠI TỬ NÃO SAU XẠ TRỊ
BSNT. Đỗ Thị Thu Trang, GS.TS Mai Trọng Khoa, PGS.TS. Phạm Cẩm Phương
Trung tâm Y học hạt nhân và Ung bướu Bệnh viện Bạch Mai
(Tổng hợp)
1. ĐẠI CƯƠNG
Xạ trị là phương pháp điều trị ung thư bằng cách sử dụng bức xạ ion hóa để tiêu diệt hoặc kiểm soát, kiềm chế sự phát triển các tế bào ác tính
Hoại tử do xạ trị, một tổn thương khu trú thường xảy ra tại vị trí khối u ban đầu, là một biến chứng lâu dài tiềm ẩn của hệ thần kinh trung ương (CNS- Central Nervous System) do xạ trị hoặc xạ phẫu. Hoại tử do xạ trị có thể xảy ra khi điều trị xạ trị các khối u hệ thần kinh trung ương nguyên phát, các khối ung thư di căn hoặc các khối u ác tính ở đầu và cổ. Nó có thể xảy ra thứ phát sau bất kỳ hình thức hoặc phác đồ xạ trị nào
Hoại tử do bức xạ có thể gây tử vong. Nó cũng có thể gây ra các vấn đề liên quan đến tổn thương khối u, chẳng hạn như co giật, thiếu hụt cục bộ, tăng áp lực nội sọ và hội chứng thoát vị.
1.1. Đặc điểm của hoại tử não sau xạ trị
- Xảy ra sớm nhất là vài tháng đến vài năm sau khi điều trị (thường xảy ra sau 6 tháng đến 2 năm sau khi xạ trị)
- Tổn thương không hồi phục
- Có thể tiến triển hoặc tự giới hạn - Tổn thương do bức xạ có thể xảy ra ở 5-37% bệnh nhân được điều trị khối u nội sọ
1.2. Các yếu tố nguy cơ hoại tử não sau xạ trị
- Xạ trị: kỹ thuật xạ, liều xạ tích lũy cao, phân liều hàng ngày cao, thể tích được điều trị lớn, thời gian điều trị dài, xạ trị sọ não trước đó - Điều trị phối hợp xạ trị: hóa trị, điều trị đích - Nhu mô não: loại u, kích thước tổn thương lớn, các đột biến gen, bệnh lý tại não - Cá thể nhạy cảm tia xạ: thiếu hụt sửa chữa DNA, trẻ em có thể có khả năng bị hoại tử do bức xạ cao hơn so với người lớn
1.3. Sinh lý bệnh
Hình 1: Sinh lí bệnh hoại tử não sau xạ trị
Xạ trị tạo ra các gốc oxy hóa phản ứng trong DNA của tế bào. Các tế bào khối u có khả năng sửa chữa DNA kém hơn các tế bào khỏe mạnh. Do đó, giữa các phân liều, các tế bào khỏe mạnh có khả năng tự sửa chữa cao hơn các tế bào khối u. Sau mỗi lần nguyên phân tiếp theo, các tác động tích lũy của DNA chưa được sửa chữa dẫn đến apoptosis (chết theo chương trình) của các tế bào khối u này
Hoại tử não do bức xạ bắt đầu bằng tổn thương mạch máu do bức xạ, xảy ra trong vòng 24 giờ đầu sau khi chiếu xạ, và sau đó là tổn thương nhu mô não. Bức xạ ion hóa tạo ra các gốc oxy hóa phản ứng trong các tế bào khối u, dẫn đến tổn thương DNA sợi đơn và sợi đôi. Các con đường sửa chữa DNA sau đó được kích hoạt, dẫn đến việc ngừng chu kỳ tế bào và dẫn đến chết theo chương trình của các tế bào có DNA bị hư hỏng không thể phục hồi. Các tế bào nội mô cũng bị tổn thương do bức xạ tương tác với màng tế bào gây ra chết tế bào theo chương trình do ceramide gây ra. Điều này khởi đầu một loạt các sự kiện dẫn đến phồng tế bào và hoại tử, sản xuất nhiều gốc oxy hóa phản ứng hơn và sau đó lan truyền phản ứng viêm liên quan đến cytokine và chemokine. Điều này dẫn đến sự hình thành huyết khối fibrin-tiểu cầu và hoại tử fibrinoid. Do đó, sự gián đoạn hàng rào máu não xảy ra và dẫn đến phù não.
Ngoài tổn thương nội mô, bức xạ còn làm tổn thương tế bào hình sao, tế bào ít nhánh và tế bào tiền thân thần kinh. Phản ứng viêm và sự hình thành các mảnh vụn khối u hoại tử không dễ dàng loại bỏ làm trầm trọng thêm các khiếm khuyết về tính thấm mao mạch và thúc đẩy quá trình mất myelin. Những thay đổi này đặc trưng cho giai đoạn trì hoãn sớm của hoại tử não do bức xạ, có thể khó phân biệt với sự tiến triển của khối u. Giai đoạn trì hoãn không hồi phục của hoại tử não do bức xạ có nhiều đặc điểm, từ hoại tử khu trú do bức xạ đến bệnh não trắng lan tỏa với teo não. Tổn thương não do bức xạ chủ yếu được thấy ở chất trắng
Vai trò của yếu tố tăng trưởng nội mô mạch máu (VEGF- Vascular Endothelial Growth Factor) và yếu tố gây thiếu oxy-1 alpha (HIF-1α) trong quá trình sinh bệnh của hoại tử não do bức xạ đã trở nên rõ ràng hơn trong những năm gần đây. HIF-1α là chất hoạt hóa chuyển hóa của VEGF và sự điều hòa tăng của nó gây ra sự gia tăng sản xuất VEGF bởi tế bào hình sao, dẫn đến sự hình thành mạch máu mới. Tuy nhiên, các mạch máu bắt nguồn từ phản ứng như vậy rất dễ vỡ và rò rỉ, gây phù nề quanh tổn thương, đặc trưng cho giai đoạn cấp tính của hoại tử não do bức xạ. Người ta đã tìm thấy sự gia tăng VEGF ở vùng quanh hoại tử của các ổ hoại tử não ở mô hình động vật. HIF-1α cũng là một chất điều hòa quan trọng của các chất trung gian trục chemokine quan trọng CXCL12-CXCR4, việc ức chế chất này cùng với ức chế HIF-1α đã được chứng minh là làm giảm sự phát triển của hoại tử não do bức xạ ở mô hình động vật.
2. TRIỆU CHỨNG LÂM SÀNG
- Tùy thuộc vào vị trí khối u và tốc độ phát triển, hoại tử do xạ trị có thể biểu hiện bằng: + Các dấu hiệu của hiệu ứng khối + Tăng áp lực nội sọ + Các hội chứng thoát vị.
+ Các triệu chứng thần kinh khu trú
- Hoại tử do xạ trị liên quan đến thùy trán hoặc thùy thái dương có thể gây ra những thay đổi về nhận thức và tính cách, mất trí nhớ
- Vì hoại tử do bức xạ xảy ra ở cùng vùng với nền khối u ban đầu, cần đánh giá các chức năng cụ thể cho vùng đó của hệ thần kinh trung ương.
3. MÔ BỆNH HỌC
Mô bệnh học là tiêu chuẩn vàng để chẩn đoán hoại tử não sau xạ trị. Các đặc điểm của hình ảnh hoại tử não sau xạ trị có thể thấy trên mô bệnh học là:
- Hyalin hóa, hoại tử mạch máu - Hyalin hóa, xâm nhập tế bào viêm - Xơ hóa tế bào thần kinh đệm (gemistocytitic astrocytes representing with atypia) - Tổn thương chất trắng nhiều hơn chất xám - Có thể thấy một số tế bào ác tính còn sót lại
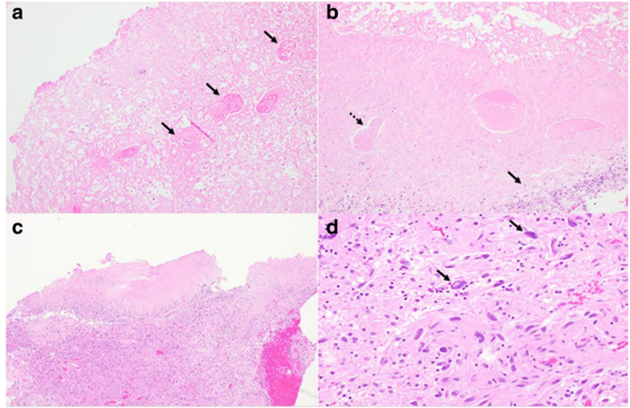 Hình 2: Hình ảnh mô bệnh học hoại tử não sau xạ trị
Hình 2: Hình ảnh mô bệnh học hoại tử não sau xạ trịa. Mô bệnh học cho thấy hoại tử rộng, bao gồm hoại tử mạch máu (mũi tên đen). Không phát hiện thấy ung thư biểu mô di căn trong các phần mô. b. Phần nhuộm H&E từ mô não lấy từ một bệnh nhân có tiền sử u nguyên bào thần kinh đệm đã trải qua phẫu thuật và xạ trị. Mô bệnh học cho thấy các đặc điểm mô học của hoại tử não do xạ trị, bao gồm nhu mô não hoại tử với hoại tử mạch máu (mũi tên nét đứt). Có một cụm đại thực bào (mũi tên đen) ở rìa phần cắt. Các vùng có u nguyên bào thần kinh đệm còn sót lại (c) được xác định bằng các tế bào đa hình kỳ lạ cho thấy những thay đổi liên quan đến điều trị (mũi tên) (d)
Sinh thiết và đánh giá mô bệnh học vẫn là tiêu chuẩn vàng để phân biệt tái phát khối u với hoại tử não sau xạ trị. Tuy nhiên, sinh thiết định vị có thể gây ra sai lệch khi lấy mẫu, đặc biệt là ở các tổn thương có vùng chứa cả khối u tái phát và hoại tử não sau xạ trị.. Ngoài ra, sinh thiết mang theo các rủi ro liên quan đến thủ thuật phẫu thuật và thực tế không thể lặp lại với tần suất thường xuyên. Do đó, người ta nghĩ đến việc phát triển các phương pháp chẩn đoán không xâm lấn, tiết kiệm chi phí để phân biệt khối u tái phát với hoại tử não sau xạ trị. với độ nhạy và độ đặc hiệu cao. Một số kỹ thuật chẩn đoán hình ảnh đã được nghiên cứu để cải thiện độ chính xác của chẩn đoán.
4. CHẨN ĐOÁN HÌNH ẢNH
Có một số kỹ thuật chẩn đoán hình ảnh cơ bản và nâng cao có thể được sử dụng để chẩn đoán hoại tử não do xạ trị, và phân biệt nó với sự tiến triển của khối u. Chụp cộng hưởng từ (MRI- Magnetic Resonance Imaging) là phương thức nền tảng để đánh giá hình ảnh về đáp ứng điều trị ở khối u não. Sự hiện diện của sự tăng tín hiệu đã được chấp nhận như một dấu hiệu của khả năng sống của khối u. Tuy nhiên, chẩn đoán phân biệt đối với các tổn thương tăng tín hiệu mới sau điều trị rất rộng và bao gồm tất cả các quá trình làm thay đổi tính thấm của hàng rào máu não, bao gồm sự tiến triển của khối u, tổn thương mao mạch do hóa xạ trị, thiếu máu cục bộ và chấn thương do phẫu thuật.
4.1. Cộng hưởng từ (MRI- Magnetic resonance imaging)
Những thay đổi tín hiệu MRI trong hoại tử do bức xạ không thể phân biệt được với những thay đổi liên quan đến khối u. Tuy nhiên, có một số đặc điểm hình ảnh đã được xác định có lợi cho chẩn đoán hoại tử não do xạ trị. Bao gồm:
- Tổn thương tăng tín hiệu hình vòng nhẫn trên nền khối u được điều trị và phù não xung quanh - Tổn thương tăng tín hiệu dạng nốt mới biểu hiện hình bong bóng xà phòng hoặc hình pho mát Thụy Sĩ - Tổn thương chất trắng có diện tích lớn hơn tổn thương chất xám. Tổn thương tín hiệu cao ở chất trắng quanh não thất trên T2 - Thương số tổn thương (Leision quotient- LQ) là tỷ lệ diện tích cắt ngang (CSA) tối đa của tổn thương khi nhìn thấy trên T2WI và CSA của tổn thương tăng tín hiêu khi nhìn thấy trên T1WI tiêm thuốc, LQ ≤0,3: gợi ý khả năng cao hoại tử não do bức xạ.
Hình 3: Hình ảnh tổn thương hoại tử não sau xạ trị trên phim chụp cộng hưởng từ. Tổn thương tăng tín hiệu hình vòng nhẫn (hình mũi tên) trên nền khối u được điều trị và phù não xung quanh
4.2. Cộng hưởng từ khuếch tán (DWI- Diffusion weighted imaging)
Hình 4: A. Ảnh T1 có tiêm thuốc đối quang từ cho thấy sự tăng tín hiệu dạng vòng. B. Hình ảnh Diffusion và C. Bản đồ ADC cho thấy sự hạn chế khuếch tán bên trong tổn thương tăng tín hiệu dạng vòng.
DWI cho phép đo độ khuếch tán như một hệ số khuếch tán biểu kiến (ADC), có thể được sử dụng để giúp phân biệt hoại tử não do bức xạ với sự tiến triển của khối u. Sự tăng sinh tế bào khối u nhanh chóng làm tăng mật độ quần thể tế bào và màng tế bào bán thấm trong một voxel nhất định, dẫn đến giảm tuyến tính độ khuếch tán nước và do đó làm giảm giá trị ADC được đo. Hoại tử, phù nề và bất kỳ quá trình bệnh lý nào cũng phá vỡ màng bán thấm làm giảm mật độ tế bào và tăng giá trị ADC theo tỷ lệ. Chụp ảnh tensor khuếch tán (DTI) là một biến thể của DWI, thu thập thông tin bổ sung liên quan đến hướng chuyển động của nước bên trong các voxel dưới dạng bất đối xứng phân đoạn (FA- Fractional anisotropy). Hoại tử gây mất cấu trúc tế bào và các sợi bình thường, từ đó phá vỡ sự khuếch tán nước, tạo ra các giá trị FA thấp. Điều thú vị là, các giá trị FA thấp cũng có thể gặp trong một khối u đang phát triển, do sự gián đoạn trong nhu mô xung quanh. Có dữ liệu hạn chế về lợi ích của FA trong việc phân biệt hoại tử não do bức xạ với sự tiến triển của khối u ở các khối u não nguyên phát và di căn.
4.3. Cộng hưởng từ tưới máu (PWI- Perfusion MRI)
Hình 5: Đặc điểm MRI của u nguyên bào thần kinh đệm (GBM- Glioblastoma) và hoại tử do xạ trị trong từng trường hợp.
a. Trường hợp 1 có GBM và hoại tử do xạ trị sau đó ở thùy thái dương trái.
b. Trường hợp 2 có GBM và hoại tử do xạ trị ở thùy thái dương trái.
c. Trường hợp 3 có GBM và hoại tử do xạ trị ở thùy trán phải.
Chụp cộng hưởng từ tưới máu bao gồm một nhóm các kỹ thuật cộng hưởng từ có thể đánh giá định lượng các biến số huyết động học não khác nhau như thể tích máu não tương đối (rCBV- relative cerebral blood volume), lưu lượng máu não (CBF- Cerebral blood flow), tính thấm mao mạch (Ktrans), thời gian vận chuyển trung bình (MTT- Mean transit time ) và các biến số khác. rCBV là một dấu hiệu hình ảnh của quá trình tân sinh mạch máu và giảm trong hoại tử não do bức xạ. Tỷ lệ các giá trị CBV thu được từ tổn thương mục tiêu và mô bình thường ở bên đối diện có thể được sử dụng để ước tính mật độ vi mạch mô và phân biệt giữa hoại tử não do bức xạ và sự tiến triển của khối u. Nhìn chung, các khối u tái phát được phát hiện có tỷ lệ rCBV từ 2,5 trở lên, trong khi tỷ lệ rCBV < 0,6 có liên quan đến hoại tử não do bức xạ. Tỷ lệ rCBV là 2,1 được phát hiện có độ nhạy 90% và độ đặc hiệu 80%.
4.4. Cộng hưởng từ phổ (MRS- Magnetic Resonance Spectroscopy)
Hình 6: Hình ảnh FLAIR (A) và hình ảnh T1 sau tiêm thuốc đối quang từ (B) thu được 8 tháng sau khi phẫu thuật, xạ trị và hóa trị một khối u thần kinh đệm anaplastic ở thùy trán trái cho thấy một vùng tăng tín hiệu mới trên FLAIR (mũi tên, A) và một nốt tăng tín hiệu (mũi tên, B) ở thùy trán phải trong thể tích được chiếu xạ, nghi ngờ bị tổn thương do xạ trị. D, Hình ảnh cộng hưởng từ phổ cho thấy cường độ tín hiệu NAA giảm nhẹ và Cho tăng ở cả hai bên, gợi ý tổn thương do xạ trị.
Cộng hưởng từ phổ là một kỹ thuật chụp ảnh không giải phẫu xác định sự hiện diện và nồng độ của nhiều chất chuyển hóa khác nhau trong một vùng não đã chọn trước đó. Trong não bình thường, các chất chuyển hóa như N-acetyl aspartate (NAA- một dấu hiệu của chức năng tế bào thần kinh bình thường) và choline (Cho- thành phần của màng tế bào) là các đỉnh chiếm ưu thế trong đồ thị quang phổ. Do đó, sự thay đổi trong thành phần chuyển hóa trong não (tổn thương tế bào thần kinh, tính dẻo của tế bào thần kinh, v.v.) sẽ làm thay đổi nồng độ tương đối của các hợp chất đó. MRS cũng có thể phát hiện lipid (Lip), biểu thị tổn thương/hoại tử. Tỷ lệ đỉnh MRS có thể hỗ trợ chẩn đoán chính xác và phân biệt hoại tử não do bức xạ với tiến triển khối u.Tỷ lệ NAA/Creatinin (Cr; một dấu hiệu của dự trữ năng lượng tế bào) cao hơn ở hoại tử não do bức xạ so với tiến triển khối u, trong khi tỷ lệ Cho/NAA và Cho/Cr cao hơn ở khối u tái phát so với tổn thương hoại tử. Đáng chú ý là MRS đòi hỏi thời gian quét dài vì cần phải chụp nhiều lần để đánh giá chính xác và là một phương thức chẩn đoán tốn kém. Các dấu hiệu chuyển hóa MRS mới như 2-hydroxyglutarate đang được nghiên cứu chuyên sâu; tuy nhiên, ứng dụng lâm sàng của nó vẫn còn hạn chế 4.5. Chụp cắt lớp phát xạ positron (PET-CT- Positron Emission Tomography and Computed Tomography)
PET là một kỹ thuật chụp ảnh chức năng y học hạt nhân đánh giá hoạt động trao đổi chất. Cơ sở lý luận đằng sau PET để phân biệt sự tái phát/tiến triển của khối u với hoại tử não sau xạ trị là sự trao đổi chất tăng lên trong khối u đang phát triển dẫn đến sự hấp thụ chất đánh dấu phóng xạ tăng lên so với hoại tử não sau xạ trị. [18F]-2-fluoro-2-deoxy-Dglucose (FDG) là một chất tương tự glucose được sử dụng làm chất đánh dấu phóng xạ tiêu chuẩn cho chụp PET ung thư. Chẩn đoán khối u não tái phát bằng FDG-PET đã được báo cáo trong các tài liệu với độ thay đổi rộng, với độ nhạy dao động từ 40% đến 95% và độ đặc hiệu dao động từ 50% đến 100%. Ngoài ra, do tế bào não sinh lý bình thường được đặc trưng bởi mức tiêu thụ glucose cao, FDG-PET không phải là chất đánh dấu phóng xạ lý tưởng trong não. Vì khối u đang phát triển cũng cho thấy sự gia tăng hấp thu axit amin, nên các chất tương tự axit amin, chẳng hạn như L-methyl-11C-methionine (MET), O-2-18F-fluoroethyl-L-tyrosine (FET) và 3,4-dihydroxy-6-18fluoro-L-phenylalanine (FDOPA), cũng đã được nghiên cứu như chất đánh dấu phóng xạ để phân biệt khối u tái phát với hoại tử não sau xạ trị. Độ đồng nhất được cải thiện cùng với sự hấp thụ thấp trong mô não sinh lý bình thường cho phép độ tương phản giữa khối u và tế bào bình thường tốt hơn đã làm tăng sự quan tâm đến PET có nguồn gốc từ axit amin. MET-PET đã được chứng minh là có thể phân biệt tái phát di căn não với hoại tử não sau xạ trị với độ nhạy và độ đặc hiệu lần lượt là 78% đến 82% và 75% đến 100%. Galldiks và các đồng nghiệp phát hiện ra rằng FET-PET có thể phân biệt tái phát với hoại tử não sau xạ trị với độ nhạy là 74% và độ đặc hiệu là 90%, độ nhạy này được tăng lên thêm 95% và độ đặc hiệu là 91% khi đánh giá kết hợp các đường cong thời gian-hoạt động với tỷ lệ khối u/não trung bình. Ngoài ra, bên cạnh độ chính xác được cải thiện, còn có những lợi ích khác khi sử dụng FET, loại bỏ nhu cầu sử dụng máy gia tốc cyclotron tại chỗ.
5. CHẨN ĐOÁN PHÂN BIỆT VỚI U NÃO TÁI PHÁT
| Chỉ số trên hình ảnh | U não tái phát | Hoại tử sau xạ trị |
| DWI/DTI | Chỉ số FA cao | Chỉ số FA thấp |
| Hạn chế khuếch tán | Không hạn chế khuếch tán |
| DCE-MRI | Giá trị ADC thấp | Giá trị ADC cao |
| MRS | Tỉ lệ Cho/Cr và Cho/NAA cao hơn | Tăng tỉ lệ Lactate/Cr và giảm tỉ lệ Cho/Cr |
| LQ | Tăng CBV> 2 ml/100g | Giảm CBV <2 ml/100g |
| PET/SPECT | Hoạt động chuyển hóa/ Tăng hấp thu chất đánh dấu phóng xạ | Không có hoạt động chuyển hóa/ Không hấp thu chất đánh dấu phóng xạ |
6. KẾT LUẬN
Hoại tử não sau xạ trị là tổn thương không hồi phục, dễ nhầm lẫn với các tổn thương tiến triển và giả tiến triển trên lâm sàng và cận lâm sàng. Mô bệnh học là tiêu chuẩn vàng chẩn đoán hoại tử não sau xạ trị, tuy nhiên không phải tổn thương não nào cũng có thể phẫu thuật và các cuộc phẫu thuật sọ não không cần thiết sẽ gây ảnh hưởng rất lớn đến chất lượng cuộc sống của bệnh nhân cũng như các lựa chọn điều trị sau đó. Phối hợp các phương tiện chẩn đoán hình ảnh có thể giúp chẩn đoán hoại tử não sau xạ trị với tỉ lệ chính xác cao và ít xâm lấn hơn. Cần phân biệt được tổn thương hoại tử não sau xạ trị với các tổn thương tiến triển hoặc giả tiến triển để có phương pháp điều trị thích hợp.
Tài liệu tham khảo
1. Langleben DD, Segall GM. PET in differentiation of recurrent brain tumor from radiation injury. J Nucl Med. 2000 Nov. 41(11):1861-7
2. J, et al. Cognitive disability in adult patients with brain tumors Cancer Treat Rev. 2018;65:33–40. https://doi.org/10.1016/J.CTRV.2018.02.007.
3. Takenaka N, Imanishi T, Sasaki H, Shimazaki K, Sugiura H, Kitagawa Y, et al. Delayed radiation necrosis with extensive brain edema after gamma knife radiosurgery for multiple cerebral cavernous malformations-case report. Neurol Med Chir (Tokyo). 2003;43:391–5.
4. Parvez, K.; Parvez, A.; Zadeh, G. The Diagnosis and Treatment of Pseudoprogression, Radiation Necrosis and Brain Tumor Recurrence. Int. J. Mol. Sci. 2014, 15, 11832-11846. https://doi.org/10.3390/ijms150711832
5. Tsuyuguchi N, Sunada I, Iwai Y, et al. Methionine positron emission tomography of recurrent metastatic brain tumor and radiation necrosis after stereotactic radiosurgery: is a differential diagnosis possible? J Neurosurg 2003;98(5):1056–64.
6. Terakawa Y, Tsuyuguchi N, Iwai Y, et al. Diagnostic accuracy of 11C-methionine PET for differentiation of recurrent brain tumors from radiation necrosis after radiotherapy. J Nucl Med 2008;49(5):694–9.
7. Grosu AL, Astner ST, Riedel E, et al. An interindividual comparison of O-(2-[18F]fluoroethyl)-L-tyrosine (FET)- and L-[methyl-11C]methionine (MET)- PET in patients with brain gliomas and metastases. Int J Radiat Oncol Biol Phys 2011;81(4):1049–58.
8. Rahmathulla G, Marko NF, Weil RJ. Cerebral radiation necrosis: a review of the pathobiology, diagnosis and management considerations. J Clin Neurosci. 2013;20:485–502.
9. Parvez, K.; Parvez, A.; Zadeh, G. The Diagnosis and Treatment of Pseudoprogression, Radiation Necrosis and Brain Tumor Recurrence. Int. J. Mol. Sci. 2014, 15, 11832-11846.