sự hình thành mạch và điều chế hệ thống miễn dịch. Một số nghiên cứu
chứng minh hiệu quả lâm sàng của mCT trong ung thư vú tiến triển và ung
thư phổi không phải tế bào nhỏ. Tuy nhiên, cần có thêm bằng chứng để mô
tả việc sử dụng tối ưu mCT và xác định bệnh nhân phù hợp. Thuốc uống
vinorelbine đóng vai trò quan trọng như một phương pháp điều trị
metronomic đầy hứa hẹn ở bệnh nhân ung thư vú tiến triển di căn.
Tổng quan
Hóa
trị liệu toàn thân vẫn là phương pháp điều trị phổ biến nhất của ung
thư vú tiến triển di căn. Thuốc gây độc tế bào thường được dùng với liều
dung nạp tối đa (MTD) để đạt được hiệu quả điều trị cao nhất và yêu cầu
khoảng thời gian cho phép giữa các chu kỳ cho để hồi phục do các tác
dụng phụ của hóa chất. Qua trình hóa trị gây phá vỡ tế bào tạo điều kiện
cho sự tái phát của khối u tăng sinh mạch và sự xuất hiện tình trạng
kháng thuốc. Do đó khối u không bị ảnh hưởng bởi tác dụng gây độc tế bào
của thuốc hóa trị liệu, ảnh hưởng đến sự sống thêm không tiến triển
(PFS) và sự sống thêm toàn bộ (OS) của bệnh nhân ung thư. Tuy nhiên, mô
hình MTD là một khái niệm được kế thừa từ các mô hình lý thuyết và toán
học được khái niệm hóa gần nửa thế kỷ trước. Những mô hình này có thể
được cải thiện bằng cách tính đến sự phức tạp và tiến hóa nhanh chóng
của các khối u, với mục đích cuối cùng là tối ưu hóa hiệu quả điều trị.
Hóa trị liệu metronomic (mCT), một thuật ngữ được đề xuất vào năm 2000
bởi Hanahan, là một phương pháp hóa trị mà thuốc gây độc tế bào khác với
lịch trình MTD thông thường. mCT bao gồm việc sử dụng thuốc hóa trị
thường xuyên hoặc liên tục với liều thấp, rõ rệt dưới liều so với MTD,
không có khoảng thời gian kéo dài giữa các lần điều trị duy nhất. mCT
ban đầu được coi là có cơ chế hoạt động chống ung thư, hiện được biết là
có nhiều cơ chế hoạt động, đặc biệt là vai trò điều hòa miễn dịch. Sự
thay đổi trong phương pháp điều trị này có thể cải thiện chỉ số điều trị
của thuốc bằng cách cân bằng tối ưu hoạt động và độc tính liên quan đến
điều trị, do đó cho phép kéo dài thời gian điều trị. Trên bệnh nhân
khối u rắn di căn như ung thư vú, thời gian điều trị lâu hơn có liên
quan đến tăng PFS và OS. Theo cách này, độc tính và chất lượng cuộc sống
(QoL) là những yếu tố chính có thể hướng dẫn lựa chọn các tác nhân và
lịch trình điều trị. Do đó mCT là một lựa chọn thú vị vì nó làm giảm mức
độ độc tính và giảm thậm chí xóa bỏ sự cần thiết của các tác nhân tăng
trưởng để phục hồi sau suy tủy. Hơn nữa, do việc sử dụng mCT thường
xuyên, thuốc uống thể hiện một cách tiếp cận thuận tiện hơn cho việc
quản lý theo dõi bệnh nhân. mCT là một chiến lược mới, nhằm mục đích
kiểm soát bệnh kéo dài, và đã được báo cáo dẫn đến ổn định bệnh và sống
thêm kéo dài ở những bệnh nhân mắc các khối u rắn khác nhau trong đó có
ung thư vú. Hóa trị metronomic cũng đã được nghiên cứu kết hợp với các
phương pháp điều trị chống ung thư khác như xạ trị, liệu pháp miễn dịch
và điều trị đích. Liên quan đến ung thư vú, một số loại thuốc hiện đang
được sử dụng trong các phác đồ hóa trị liệu tiêu chuẩn (ví dụ như
vinorelbine, cyclophosphamide, methotrexate và fluoropyrimidine) đã được
đánh giá trong các chế độ trị liệu bằng metronomic, thường được kết hợp
với hormone, thuốc nhắm mục tiêu như trastuzumab, bevacizumab. Trong
những nghiên cứu này mặc dù không đồng nhất trong thiết kế nhưng đã hỗ
trợ hiệu quả lâm sàng của mCT trong ung thư vú tiến triển, di căn hoặc
điều trị khó. Ngoài ra, mặc dù có bằng chứng ít mạnh mẽ hơn ở bệnh nhân
ung thư vú, các thử nghiệm mCT trong ung thư phổi không tế bào nhỏ
(NSCLC) đã cho thấy kết quả đáng khích lệ với tỷ lệ kiểm soát bệnh cao
tới 65,7%, tùy thuộc vào thiết kế được sử dụng trong mỗi nghiên cứu. Mặc
dù có những kết quả đầy hứa hẹn, nhưng cần có thêm bằng chứng để làm
sáng tỏ việc sử dụng mCT tối ưu và đặc biệt là việc xác định bệnh nhân
có nhiều khả năng hưởng lợi từ chiến lược này. Thuốc uống vinorelbine
(VNR) thuộc về một nhóm các tác nhân hóa trị duy nhất, các tác nhân nhắm
mục tiêu các tiểu vi quản. Các tác nhân này đã cho thấy hoạt động đặc
biệt về mặt ức chế sự hình thành mạch, ức chế các tế bào tiền thân nội
mô (CEP) và ức chế con đường HIF-1α. Những đặc điểm này, cùng với đường
uống (không giống như các tác nhân nhắm mục tiêu tiểu vi quản khác) và
hoạt động đã được chứng minh trong các khối u rắn khác nhau trong đó có
ung thư vú đã làm cho vinorelbine trở thành một trong những tác nhân hứa
hẹn nhất được thiết kế trong các nghiên cứu mới trong những năm gần
đây.
Nghiên cứu vai trò hóa trị metronomic trong ung thư vú tiến triển di căn
Ung
thư vú đại diện cho khối u với phần lớn dữ liệu mCT có sẵn mặc dù tất
cả các thử nghiệm lâm sàng đã được thực hiện trong pha I hoặc pha II.
Đặc biệt, mVNR đường uống đã được đánh giá trong một số thử nghiệm lâm
sàng do hoạt động trong ung thư vú tiến triển với lịch trình MTD thông
thường và đã cho thấy một hồ sơ độc tính thuận lợi, khả năng dung nạp
tốt và không có độc tính tích lũy. Trong một nghiên cứu của Addeo và
cộng sự, mVNR đường uống với liều đầu tiên 70 mg / m2, được phân chia
vào các ngày 1, 3 và 5, trong 3 tuần và 1 tuần nghỉ, cứ sau 4 tuần, được
dùng cho 34 bệnh nhân cao tuổi bị ung thư vú di căn (tuổi trung bình:
74 tuổi, lứa tuổi 70 đến 84). Bệnh nhân được điều trị tối đa 12 chu kỳ.
Tỷ lệ đáp ứng hoàn toàn là 6% và 11 bệnh nhân (32%) đạt được đáp ứng một
phần. Trung vị PFS là 7,7 tháng. Không có độc tính liên quan đã được
báo cáo. Trong một nghiên cứu pha II khác, được công bố gần đây, 32 bệnh
nhân cao tuổi bị ung thư vú di căn đã nhận được tổng cộng 30 mg mVNR
khi điều trị đầu tiên hoặc tiếp theo, cho đến khi bệnh tiến triển hoặc
độc tính không thể chấp nhận. Không có sự kiện bất lợi độ 3 và 4 đã được
báo cáo. Tỷ lệ đáp ứng toàn bộ (ORR) là 68,7% bao gồm 6 đáp ứng hoàn
toàn (CR: 18,8%) và 16 đáp ứng một phần (PR: 50%). Sáu bệnh nhân (18,7%)
đạt được bệnh ổn định (SD) với tỷ lệ kiểm soát bệnh là 87,4%. Tỷ lệ lợi
ích lâm sàng là 50%. Theo dõi trung bình 12 tháng, PFS trung vị là 9,2
tháng. Vai trò của mVNR đường uống cũng được khám phá ở những bệnh nhân
bị di căn não do ung thư vú. Tổng cộng có 36 nữ giới bị di căn não mới
được chẩn đoán đã được điều trị temozolomide, sau đó điều trị 4 tuần và
sau đó uống mVNR (70 mg / m2, vào các ngày 1, 3 và 5, hàng tuần trong ba
tuần liên tiếp) cộng với temozolomide, điều trị đến 12 chu kỳ. Kết quả
ORR là 52% (3 đáp ứng hoàn toàn), và PFS và trung bình OS lần lượt là 8
và 11 tháng. Các tác dụng phụ là nhẹ trong hầu hết các trường hợp. Có
một lý do cho sự kết hợp giữa mCT và các tác nhân chống ung thư nhắm mục
tiêu như bevacizumab. Trong các mô hình tiền lâm sàng, sự kết hợp của
mCT với kháng thể VEGFR2 dẫn đến kết quả bền vững của các khối u lớn mà
không có độc tính rõ rệt trong quá trình điều trị. Trong một nghiên cứu
pha II, 13 bệnh nhân được điều trị trước đó đã nhận được mVNR uống (50
mg ba lần một tuần) và bevacizumab (10 mg / kg hai lần một tuần) trong
chu kỳ 28 ngày. Sự kết hợp được dung nạp tốt. Một bệnh nhân (7,7%) đã
đạt được một phần đáp ứng và sáu (46,1%) đạt được sự ổn định của bệnh:
do đó, nghiên cứu đã bị đóng cửa sớm do thiếu hiệu quả. Các tác giả cho
rằng các nghiên cứu sâu hơn nên tập trung vào các điểm cuối nhạy cảm hơn
với tác động của các tác nhân mục tiêu, chẳng hạn như bệnh mãn tính.
Trong một thử nghiệm được công bố vào năm 2012, các liều sử dụng mVNR
leo thang (liều khởi đầu 30 mg) mỗi ngày liên tục và capecitabine (liều
khởi đầu 800 mg / m2) vào ngày 1- 14, cứ sau 21 ngày trên nữ giới bị ung
thư vú di căn. Tổng cộng trên 36 nữ giới (24 người điều trị bước đầu)
đã được ghi nhận ở tám mức liều leo thang. Mức độ độc tính giới hạn liều
(DLT) đạt được ở mVNR 70 mg và capecitabine 1250 mg / m2, và MTD được
khuyến nghị là vinorelbine 60 mg và capecitabine 1250 mg / m2. Có hai
đáp ứng hoàn toàn và mười đáp ứng một phần. Trên cơ sở những dữ liệu
này, mVNR đường uống với capecitabine metronomic đã được đánh giá thêm
trong một nghiên cứu pha I và pha II lớn hơn (VICTOR-1), trong đó ghi
nhận bệnh nhân sau mãn kinh được điều trị bằng anthracycline và taxanes.
Nghiên cứu này bao gồm pha I, trong đó 12 bệnh nhân đã nhận được một
liều capecitabine cố định liên tục (500 mg ba lần một ngày) và tăng liều
mVNR đường uống (20 - 40 mg ba lần một tuần với tăng liều nếu không có
báo cáo về độc tính). MTD của vinorelbine là 40 mg. Trong pha II tiếp
theo, 32 bệnh nhân khác đã nhận được MTD của vinorelbine cộng với
capecitabine trong tổng số 187 chu kỳ. Độc tính độ 3 - 4 đã được báo cáo
ở 5,9% bệnh nhân và tỷ lệ lợi ích lâm sàng (được xác định là CR + PR +
SD ≥ 24 tuần) là 58,1%. Một hồ sơ an toàn tương tự đã được quan sát
trong nhóm phụ của bệnh nhân cao tuổi (n = 18; tuổi trung bình: 76 tuổi)
ghi nhận trong cùng một nghiên cứu; tỷ lệ lợi ích lâm sàng trong nhóm
này là 66,7% [Cazzaniga ME, Torri V Riva F và cộng sự, dữ liệu chưa được
công bố]. Do hồ sơ an toàn thuận lợi, lịch trình được thông qua có thể
được coi là lịch trình tiêu chuẩn để đánh giá thêm. Lưu ý, việc xác định
dấu ấn sinh học và đặc điểm khối u cụ thể sẽ hữu ích để giải quyết tốt
hơn việc sử dụng mCT như liệu pháp duy trì trong ung thư vú tiến triển
di căn.
Ca lâm sàng
Bệnh nhân nữ 50 tuổi, địa chỉ ở Hòa Bình. Được chẩn
đoán ung thư vú bên trái tái phát di căn phổi sau phẫu thuật và hóa trị
từ năm 2013. Đợt này từ tháng 1 năm 2015 bệnh nhân xuất hiện đau ngực
bên trái, thỉnh thoảng khó thở, ăn uống kém, người mệt mỏi. bệnh nhân
đến khám tại Bệnh viện Bạch Mai trong tình trạng: thể
trạng gầy, cao 1m50, nặng 40kg, da, niêm mạc bình thường, tuyến giáp
không to, hạch ngoại biên không sờ thấy, vú bên trái đã phẫu thuật cắt
toàn bộ, vú bên phải không sờ thấy u. Tim nhịp đều, T1T2 rõ, không nghe
thấy tiếng thổi. Phổi RRFN rõ, không rales. Bụng mềm, gan lách không sờ
thấy. Cơ quan khác: bình thường. Công thức máu: HC: 4,52 (T/L), HB: 126 (g/L), TC: 328 (G/L), BC: 4,13 (G/L). Sinh hóa: ure: 3,0 (mmol/l), Glucose: 7,3 (mmol/l), Creatinin: 68 (umol/l), GOT: 15 (U/L), GPT: 18 (U/L). Chỉ điểm khối u: CA15-3: 45,7 (U/ml). Điện tâm đồ: bình thường. Siêu âm bụng: tràn dịch màng phổi, u gan bên trái nghi di căn. Chụp CT ngực: đám mờ phổi phải kích thước 27 x 25 (mm), tràn dịch màng phổi phải. Xạ hình xương: bình thường. Mô bệnh học: Ung thư biểu mô thể ống xâm nhập độ II
|
Hình ảnh sau điều trị phẫu thuật và hóa trị:
Vú trái đã phẫu thuật cắt bỏ hoàn toàn.
Vú phải sờ không thấy u
|

|
|
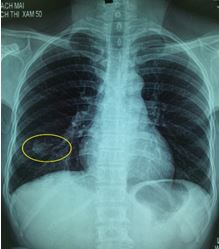
Hình ảnh Xquang phổi:
Đám mờ thùy dưới phổi bên phải
Tràn dịch màng phổi bên phải
|
|
|

|

|
|
Đám mờ thùy dưới phổi (P) KT 27 x25mm
|
|

|

|
|
Khối u gan (T) KT 25 x23 mm
|
Hiện tại bệnh nhân được chẩn đoán ung thư vú tái phát di căn phổi, gan sau điều trị phẫu thuật kêt hợp hóa trị
Điều trị cụ thể:
- Vinorelbine (Navelbine): 60mg/m2, uống ngày 1, 8, 15
Đáp ứng toàn bộ sau 3 tuần:
- Lâm sàng: bệnh nhân tăng cân, không khó thở, không đau ngực, ăn uống sinh hoạt bình thường
- Cận lâm sàng: đám mờ phổi phải và tổn thương gan trái tiêu biến
Hình ảnh CT ngực sau điều trị 3 tuần
|

|

|
|
Đám mờ phổi phải tiêu biến
|
Hình ảnh CT ngực sau điều trị 3 tuần
|

|

|
|
Khối tổn thương gan trái tiêu biến
|
So sánh trước và sau điều trị
|

|

|
|
Tổn thương phổi tiêu biến sau điều trị
|
|

|

|
|
Tổn thương gan tiêu biến sau điều trị
|
Tài liệu tham khảo
1. Romiti
A, Cox M C, Sarcina I. et al. Metronomic chemotherapy for cancer
treatment: a decade of clinical studies. Cancer Chemother
Pharmacol. 2013;72:13–33. [PubMed]
2. Rochlitz
C Moos R Biger M et al. SAKK 24/09: Safety and tolerability of
bevacizumab plus paclitaxel versus bevacizumab plus metronomic
cyclophosphamide and capecitabine as first-line therapy in patients with
HER2-negative advanced stage breast cancer—A multicenter, randomized
phase III trial J Clin Oncol201432(Suppl.)5s (Abstr. 518) [PMC free article] [PubMed]
3. Garcia-Saenz
J A, Martin M, Calles A. et al. Bevacizumab in combination with
metronomic chemotherapy in patients with anthracycline- and
taxane-refractory breast cancer. J Chemother. 2008;20:632–639. [PubMed]
4. Dellapasqua
S, Bertolini F, Bagnardi V. et al. Metronomic cyclophosphamide and
capecitabine combined with bevacizumab in advanced breast cancer. J Clin
Oncol. 2008;26:4899–4905. [PubMed]
5. Saloustros
E, Kalbakis K, Vardakis N. et al. Metronomic vinorelbine plus
bevacizumab as salvage therapy for patients with metastatic breast
cancer. J BUON. 2011;16:215–218. [PubMed]
6. Orlando
L, Cardillo A, Ghisini R. et al. Trastuzumab in combination with
metronomic cyclophosphamide and methotrexate in patients with HER-2
positive metastatic breast cancer. BMC Cancer. 2006;6:225. [PMC free article] [PubMed]
7. Schwartzberg
L S, Wang G, Somer B G. et al. Phase II trial of fulvestrant with
metronomic capecitabine for postmenopausal women with hormone
receptor-positive, HER2-negative metastatic breast cancer. Clin Breast
Cancer. 2014;14:13–19. [PubMed]
8. Ge
Y, Domschke C, Stoiber N. et al. Metronomic cyclophosphamide treatment
in metastasized breast cancer patients: immunological effects and
clinical outcome. Cancer Immunol Immunother. 2012;61:353–362. [PubMed]
9. Gebbia
V, Boussen H, Valerio M R. Oral metronomic cyclophosphamide with and
without methotrexate as palliative treatment for patients with
metastatic breast carcinoma. Anticancer Res. 2012;32:529–536. [PubMed]
10. Salem
D A, Gado N M, Abdelaziz N N. et al. Phase II trial of metronomic
chemotherapy as salvage therapy for patients with metastatic breast
cancer. J Egypt Natl Canc Inst. 2008;20:134–140. [PubMed]
11. Manso
L, Valdiviezo N, Sepulveda J. et al. Safety and efficacy of metronomic
non-pegylated liposomal encapsulated doxorubicin in heavily pretreated
advanced breast cancer patients. Clin Transl Oncol. 2013;15:467–471. [PubMed]
12. Saridaki
Z, Malamos N, Kourakos P. et al. A phase I trial of oral metronomic
vinorelbine plus capecitabine in patients with metastatic breast
cancer. Cancer Chemother Pharmacol. 2012;69:35–42.[PubMed]
13. Cazzaniga
M E, Torri V, Villa F. et al. Efficacy and safety of the all-oral
schedule of metronomic vinorelbine and capecitabine in locally advanced
or metastatic breast cancer patients: the Phase I-II VICTOR-1 Study. Int
J Breast Cancer. 2014;2014:769790. [PMC free article] [PubMed]
14. Addeo
R, Sgambato A, Cennamo G. et al. Low-dose metronomic oral
administration of vinorelbine in the first-line treatment of elderly
patients with metastatic breast cancer. Clin Breast
Cancer. 2010;10:301–306. [PubMed]
15. De
Iuliis F, Salerno G, Taglieri L. et al. On and off metronomic oral
vinorelbine in elderly women with advanced breast
cancer. Tumori. 2015;101:30–35. [PubMed]
16. De
la Haba J, Cazzaniga M, Freyer G. et al. Randomised phase II study
evaluating, as first-line chemotherapy, single-agent oral vinorelbine
administered with two different schedules in patients with hormone
receptor positive, HER2-negative advanced breast cancer (TempoBreast-1
trial). In: Proceedings of the Thirty-Eighth Annual CTRC-AACR San
Antonio Breast Cancer Symposium 2015. Cancer Res. 2016:76.
17. Addeo
R, Sperlongano P, Montella L. et al. Protracted low dose of oral
vinorelbine and temozolomide with whole-brain radiotherapy in the
treatment for breast cancer patients with brain metastases. Cancer
Chemother Pharmacol. 2012;70:603–609. [PubMed]
Nguồn: ungthubachmai.com.vn